
Investigación científica
El cáncer como no se había visto nunca
El CNIO incorporará este año un detector de electrones capaz de captar en un segundo miles de imágenes a escala atómica de los procesos que causan los tumores.
El CNIO incorporará este año un detector de electrones capaz de captar en un segundo miles de imágenes a escala atómica de los procesos que causan los tumores.
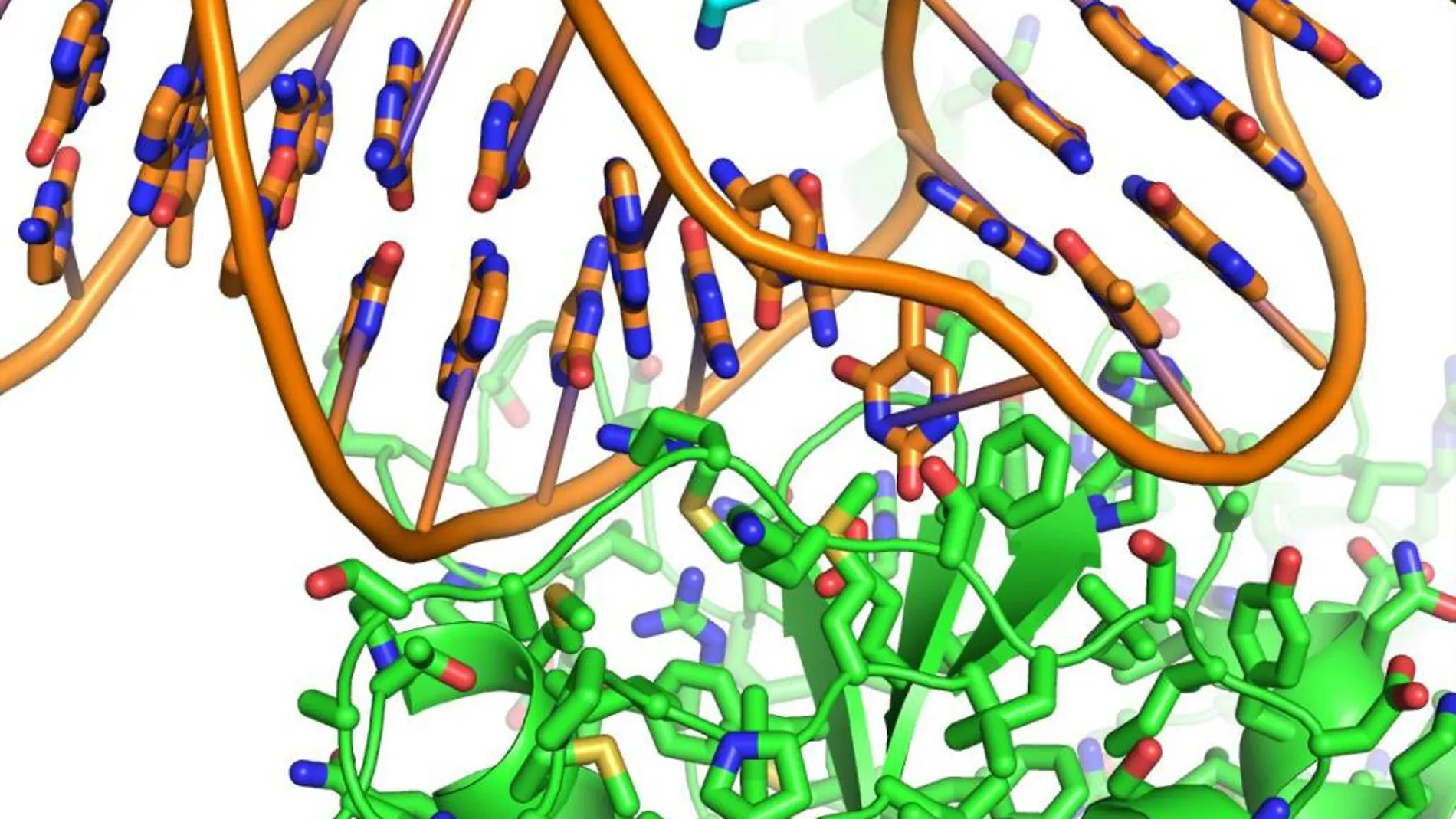
Para combatir los procesos que llevan a la aparición de un cáncer, es necesario verlos. Y a cuanta mayor resolución, todavía mejor. El Centro Nacional de Investigaciones Oncológicas (CNIO) incorporará para finales de año un crio-microscopio equipado con un detector directo de electrones. Será el segundo con el que contará nuestro país, junto al del CNB (Centro Nacional de Biotecnología) del CSIC, aunque más potente, capaz de tomar no ya una imagen estática, sino miles por segundo, hasta el punto de «grabar» una «película» del proceso cancerígeno. Y, lo que es más importante: lo hará a escala atómica, a una resolución de 0,2 nanómetros. Mañana se celebra el Día Mundial de la Investigación en Cáncer, una iniciativa promulgada por la Asociación Española contra el Cáncer (AECC) y que conmemoró ayer con la entrega de ayudas a la investigación por parte de la Reina Letizia. Ahora, este detector podrá captar hasta los átomos de las proteínas implicadas en el cáncer y otras enfermedades como hasta ahora no se había logrado.
«Hasta hace tres o cuatro años, esta técnica estaba por detrás de la máxima resolución a la que se podía llegar. La información que obteníamos era limitada. Ha habido un desarrollo de nuevas tecnologías: todo ese campo ha sufrido una revolución», explica Rafael Fernández Leiro, director del Grupo de Integridad Genómica y Biología Estructural del CNIO, dentro del programa que dirigirá el investigador Óscar Llorca. Es un primer paso, «muy importante, dadas las circunstancias de la financiación de la ciencia» en España. Así, Reino Unido cuenta con entre 10 y 15 microscopios de esta gama, a los que tienen acceso muchos investigadores. Es el mejor del mercado, con un precio que puede oscilar entre los 1,5 y los cinco millones de euros.
¿Cómo se logra este nivel de resolución atómica? A diferencia de los microscopios ópticos, que utilizan luz visible, el del CNIO utilizará electrones, lo que posibilitará una resolución más alta. Los investigadores trabajan sobre muestras congeladas de moléculas en todos sus estados. De ahí que hablemos de «crio microscopía. El detector será la «cámara» que capte las imágenes. «Cuando pones la muestra en el microscopio y los electrones pasan a través de ella, la dañan: estamos en un nivel de energía muy alto y la desintegran». Así, «tenemos que tomar esas imágenes utilizando la mínima energía posible de los electrones. Estos detectores han mejorado tanto que, en condiciones de baja iluminación, permiten tomar imágenes con suficiente información como para poder analizarlas», añade. Al final, se toman cientos de miles imágenes, que conforman «miles de películas». Y, al juntarlas, el ordenador posibilita «una reconstrucción en 3D del objeto que ponemos al microscopio, como las proteínas que interaccionan con el ADN».
Nuestro ADN cuenta con un sistema de replicación que le permite duplicarse. En este proceso, las proteínas interaccionan entre sí y se encargan de detectar y reparar errores antes de que la célula se divida, evitando así la aparición de mutaciones. Cuando el proceso falla, es cuando puede surgir un tumor. Son procesos muy dinámicos, con interacciones en muy poco tiempo. El detector captará ese momento específico.
Una de las proteínas involucradas en el cáncer son las quinasas. «Son proteínas que mutan en la mayoría de cánceres», explica a este diario Iván Plaza-Menacho, jefe del Laboratorio de Quinasas, Fosforilación de Proteínas y Cáncer del CNIO. Antes, se podían ver gracias a la técnica de la cristalografía: las proteínas se cristalizaban y se exponían a un haz de rayos X. Sin embargo, se necesitaban muchas muestras y eran muy difíciles de obtener. Ahora, la microscopía electrónica permite «no sólo ver una proteína en concreto, sino también ver como interaccionan entre sí, no sólo de una forma estática, sino también dinámica». Así, se podrán estudiar «in situ» aquellas quinasas que se encuentran, no ya en la superficie de la célula; también dentro la membrana celular. «Vamos a entender su mecanismo de acción», dice Plaza-Menacho.
¿El objetivo? Esta «revolución de la microscopía electrónica» podrá «aplicarse en el desarrollo de nuevas terapias y fármacos contra las proteínas implicadas en cáncer y otras enfermedades», afirma este investigador. Por ejemplo, podría diseñarse una terapia combinatoria, compuesta, por un lado, de varios fármacos inhibidores de la quinasa mutada y otros de las proteínas que se activan. «Tendremos la oportunidad de desarrollar fármacos que son muy específicos y que irán directamente a la diana», concluye Fernández Leiro.
✕
Accede a tu cuenta para comentar


