
Investigación científica
El cáncer puede morir
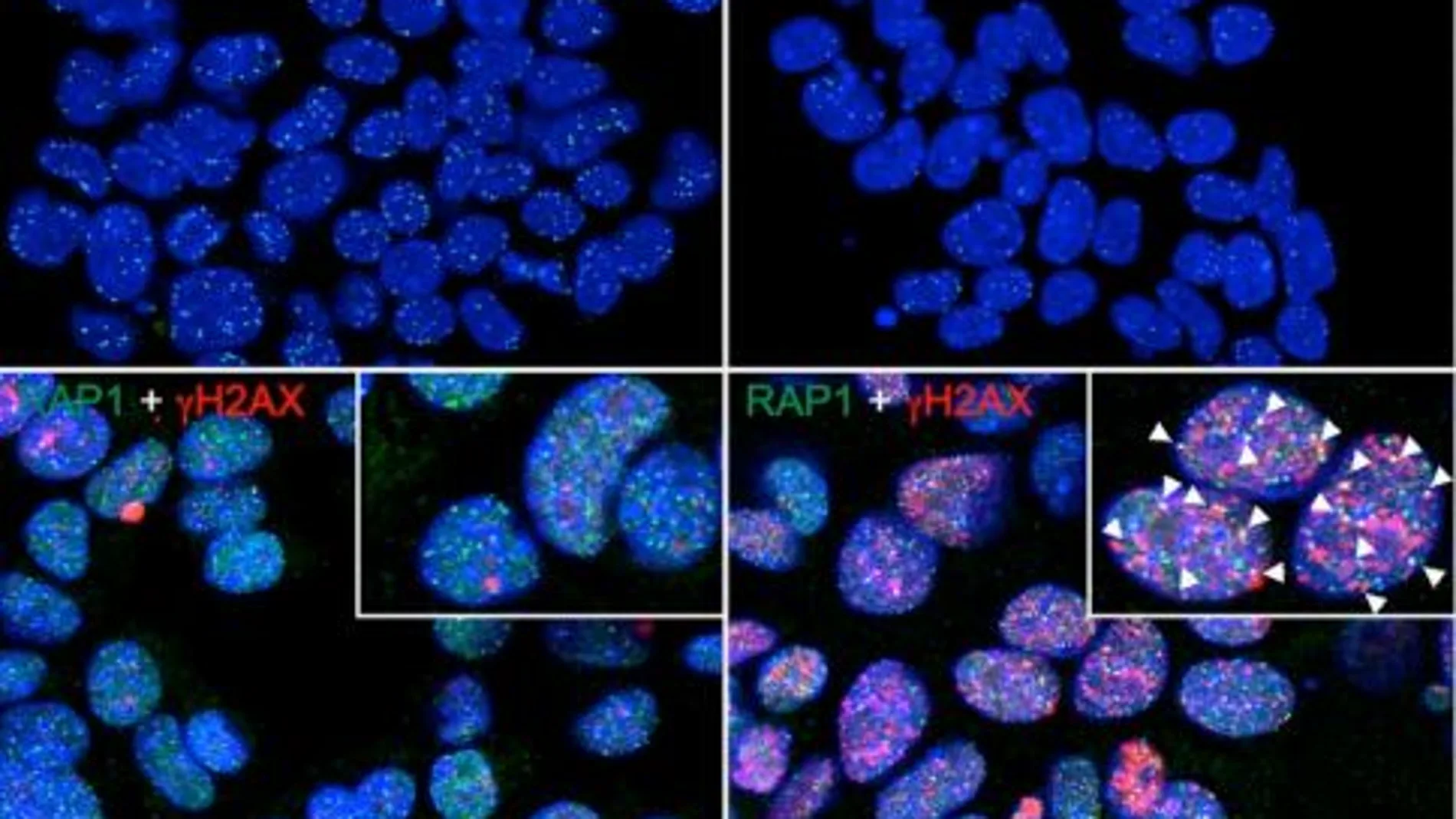
Tres científicas del CNIO determinan la forma de romper el escudo que protege a las células tumorales para evitar que se reproduzcan sin control.
Una de las características más significativas y más desesperantes de las células cancerosas es que son inmortales. Se dividen de manera descontrolada y aparentemente eterna. Su malignidad no reside necesariamente en esta facultad, pero cuando un tumor es maligno su capacidad de superviviencia casi ilimitada lo convierte en una máquina de destrucción difícil de detener. Hasta ahora. Porque un equipo de científicas españolas, investigadoras del Centro Nacional de Investigaciones Oncológicas Carlos III (CNIO), ha anunciado al mundo un espectacular avance contra el mal: por primera vez se ha conseguido que una célula cancerosa deje de ser inmortal. Y lo han logrado utilizando una nueva estrategia oncológica, completamente diferente a lo que hasta hoy componía el arsenal terapéutico contra el cáncer. Han abierto, en suma, una nueva vía para atacar la enfermedad, al menos en el tipo de cáncer de pulmón que están investigando. Permítanme que aventure que es más que probable que esta técnica termine siendo utilizada en otros muchos tipos de cáncer. La nueva herramienta pone el punto de mira en los telómeros de las células tumorales, unas estructuras genéticas que juegan un papel importantísimo en la supervivencia de estas entidades. ¿Por qué?
Nuestro cuerpo cuenta con billones de células. Constantemente hemos de remplazar una parte importante de este material viejo por células nuevas. El proceso consiste en la división permanente de las células que alcanzan un determinado estado de desarrollo. Para ello, deben duplicar su ADN. Los genes con los que fuimos «fabricados» residen en el interior de cada célula. Llegado el momento de la duplicación, ese material genético se organiza en paquetes llamados cromosomas. Los cromosomas se replican (como si alquien hiciera una fotocopia de cada uno) y pasan a formar parte de dos nuevas y jóvenes células. Cada segundo eso ocurre en nuestro interior unas 5 millones de veces.
Pero cada copia tiene su peaje. La duplicación de un cromosoma no siempre es completa. En los extremos de los cromosomas existen unas estructuras proteínicas llamadas telómeros. Son como capuchones de protección al modo de los herretes que tienen los cordones de los zapatos para evitar que se deshilachen. La copia nueva de ADN no alcanza por completo a los telómeros. En cada división se pierde parte de la información de ese extremo de los cromosomas. El herrete se va deteriorando, empequeñeciendo, hasta casi desaparecer. La longitud de los telómeros es un marcador de la edad de una célula. Llegados a un tamaño suficientemente pequeño los telómeros pierden su función protectora, la célula envejece, se convierte en tóxica para el cuerpo y es desechada. Así es también cómo envejecemos y morimos un poco nosotros.
Pero a las células cancerosas no les ocurre lo mismo. Ellas proliferan sin control y sus telómeros no se acortan sustancialmente. Una responsable de este superpoder es la telomerasa, una enzima que repara constantemente los telómeros dañados y que en la célula sana suele estar desactivada. Desde la última década del siglo pasado se ha tratado sin mucho éxito de luchar contra la telomerasa para reducir las posibilidades de supervivencia de la célula tumoral. Si se inhibe la acción de esa enzima, efectivamente, los telómeros cancerosos se acortan, pero a un ritmo muy lento. Demasiado para que la terapia sea útil. Las investigadoras del CNIO han encontrado una vía rápida para lograr que los telómeros se acorten y convertir la célula cancerosa en una célula tan mortal como las demás.
La secuencia de ADN de la que se componen los telómeros lleva adherida una familia de proteínas llamada shelterinas. La nueva estrategia consiste en atacar a una de ellas, la TRF1. Si se consigue inutilizar esta proteína, los telómeros pierden su escudo protector de manera muy rápida y la célula cancerosa envejece hasta morir. Pero ¿cómo lograr que la TRF1 deje de funcionar?
El trabajo firmado por María García-Beccaria, Paula Martínez y Marinela Méndez del grupo de Telómeros y Telomerasa del CNIO, liderado por María Blasco, ha empleado dos estrategias de ataque, una genética y otra química. La primera consiste en la creación de ratones modificados genéticamente a los que se les ha eliminado el gen responsable de producir esa proteína. La segunda trata de encontrar un fármaco que pueda afectar a la actividad de la TRF1. En ambos casos los resultados fueron sorprendentes. Las científicas usaron modelos de ratón al que se había inducido un cáncer de pulmón muy agresivo que carece de diana terapéutica hoy en día. Hay que recordar que el de pulmón es el cáncer que más seres humanos mata en el mundo.
Tanto en el caso de la modificación genética como en el del uso de compuestos químicos inhibidores de la TRF1, los telómeros de las células cancerosas se redujeron considerablemente. Además, la acción química produjo muy poca toxicidad en los ratones lo que permite augurar que en el futuro podría dar lugar a terapias con menos efectos secundarios que la quimioterapia actual. La diferencia reside en que la quimioterapia afecta a todo el material genético y esta nueva estrategia sólo deteriora el telómero.
Otro detalle importante de la investigación es que las autoras han empleado inhibidores químicos creados y patentados por el propio CNIO, que forman parte de los archivos de principios activos de la institución a través de su programa ETP (Experimental Therapeutics Program). Este programa cuenta con una base de datos de más de 50.000 sustancias susceptibles de tener un valor terapéutico futuro. En este caso, los inhibidores utilizados con éxito podrían servir de punto de partida para la generación de fármacos que deterioren los telómeros de la célula tumoral a gran escala.
De hecho el CNIO ya ha anunciado una ronda de conversaciones con la industria farmacéutica para tratar de llegar a acuerdos de producción de ese posible nuevo fármaco. Es el primer paso de una todavía larga cadena de acontecimientos hasta que se pueda conseguir un medicamento probadamente eficaz y disponible que constituya una nueva herramienta con la que los médicos podrán poner coto al desarrollo del cáncer.
✕
Accede a tu cuenta para comentar


