
Aborto
Un fármaco abortivo disfrazado de anticonceptivo
La Agencia Europea del Medicamento suprime del prospecto la mención al efecto posfecundación de la píldora de los cinco días
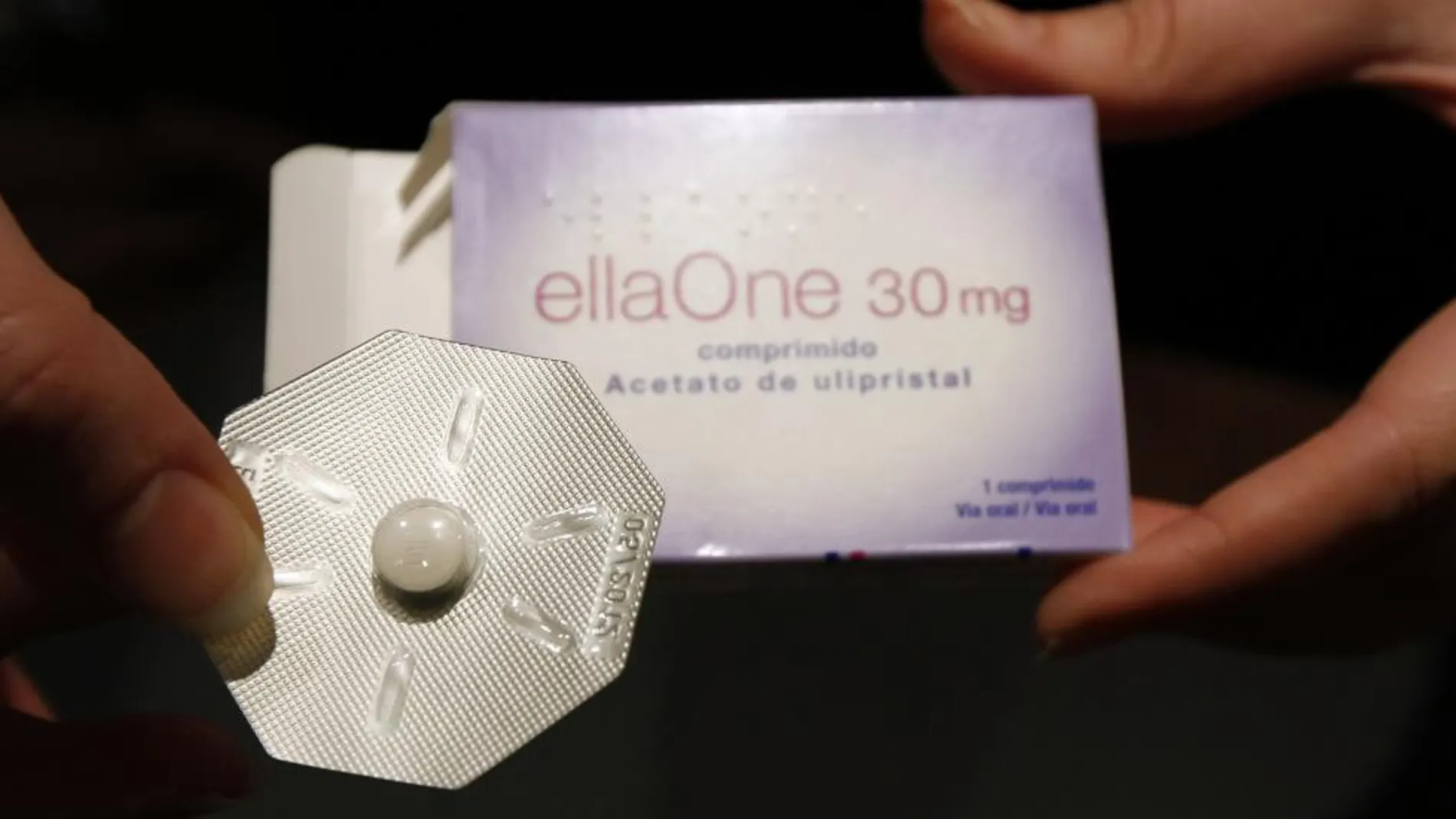
La Agencia Europea del Medicamento suprime del prospecto la mención al efecto posfecundación de la píldora de los cinco días
En mayo de 2009, la Agencia Europea del Medicamento (EMA, por sus siglas en inglés), autorizó el anticonceptivo de emergencia ellaOne, más conocido como la píldora de los cinco días por su capacidad para evitar embarazos no deseados hasta 120 horas después de una relación sexual sin protección. Aunque en un primer momento la EMA incluyó en la ficha técnica del fármaco que parte de su efecto consistía en alterar el endometrio para evitar la implantación del embrión humano ya fecundado, esta mención desapareció pocos meses después, omitiendo así una información vital para las posibles usuarias: el efecto abortivo de la píldora de los cinco días.
Lo llamativo es que el propio laboratorio –HRA Pharma– ni siquiera esperó a este cambio de criterio por parte de le EMA y ya varios meses antes publicitaba ellaOne sin hacer referencia alguna a su posible efecto antiimplantatorio en los folletos que repartía en las farmacias españolas.
Ante estos hechos, la Asociación Española de Farmacia Social (Aefas) interpuso una denuncia ante la Consejería de Sanidad de la Comunidad de Madrid, alertando de la contradicción entre la información publicada por la EMA y la publicidad del laboratorio. Con todo, la sorpresa sobrevino cuando los inspectores madrileños informaron a una farmacéutica de Aefas de la modificación de la ficha técnica de la píldora de los cinco días por parte de la Agencia Europea del Medicamento para adaptarla a la información sumistrada por el laboratorio fabricante.
El problema no reside sólo en el cambio del prospecto en sí mismo, sino que, sobre la base de las evidencias científicas disponibles hasta hoy, la actividad sobre el endometrio del ulipristal acetato –principio activo de la píldora de los cinco días– está «fuera de toda duda», como aseguran desde la Aefas. Asimismo, los farmacéuticos de esta asociación denuncian que en el documento de la EMA en el que se justifican los cambios «no aportan ningún dato que desmienta esta actividad endometrial bien contrastada, más bien al contrario, la confirman». Analizando los datos de la eficacia clínica de ellaOne, sobre todo en administraciones tardías pero aún dentro de las 120 horas posteriores a la relación sexual en las que es eficaz, se observa que una vez producida la ovulación, la píldora mantiene una eficacia contraceptiva del 75 por ciento. «Si no existe actividad anovulatoria llegado este momento, debe existir otro mecanismo distinto a éste, con efecto posovulatorio, que justifique la alta eficacia del ulipristal», argumenta la Aefas.
Aunque la Aefas ha reclamado un cambio de la ficha técnica de la píldora de los cinco días en varias ocasiones, ni la EMA ni la Comisión Europea han atendido por el momento estas peticiones, al considerar que «la información del resumen de las características del producto es suficiente». Todo ellos a pesar de que en algunos de los propios estudios aportados por la EMA se comprueba que ellaOne tiene «actividad sobre el endometrio», aun en dosis bajas, provocando «una significativa reducción en el grosor del endometrio» e «inhibiendo la maduración endometrial». Por todos estos motivos, la asociación farmacéutica entiende que se trata de un tema «de gran trascendencia, no sólo desde una perspectiva médica –información a los profesionales sanitarios–, sino también social y ética», pues las potenciales usuarias «tienen derecho a conocer el mecanismo de acción del medicamento», máximo cuando éste podría estar relacionado con posibles efectos abortivos.
De esta forma, mientras que en la propia página web de ellaOne se asegura que actúa «previniendo o retrasando la ovulación, evitando que los espermatozoides se encuentren con el óvulo y evitando así el embarazo», lo cierto es que esta es sólo uno de sus formas de acción, respondiendo parte de su eficacia a efectos posfecundación. Este fármaco, para el que en la actualidad se precisa receta médica –al igual que la píldora del día después– está disponible en España desde finales de 2009. Hasta este año se han vendido en nuestro país un total de 42.432 dosis de esta pastilla, con un valor estimado de mercado de 891.702 euros, según los datos que proporciona la consultora IMS Health.
✕
Accede a tu cuenta para comentar


