
Inmunidad
Moderna probará su vacuna en 3.000 adolescentes de entre 12 y 17 años
La Comisión Europea baja de 67 a 3 los días para autorizar las vacunaciones tras el sí de la EMA
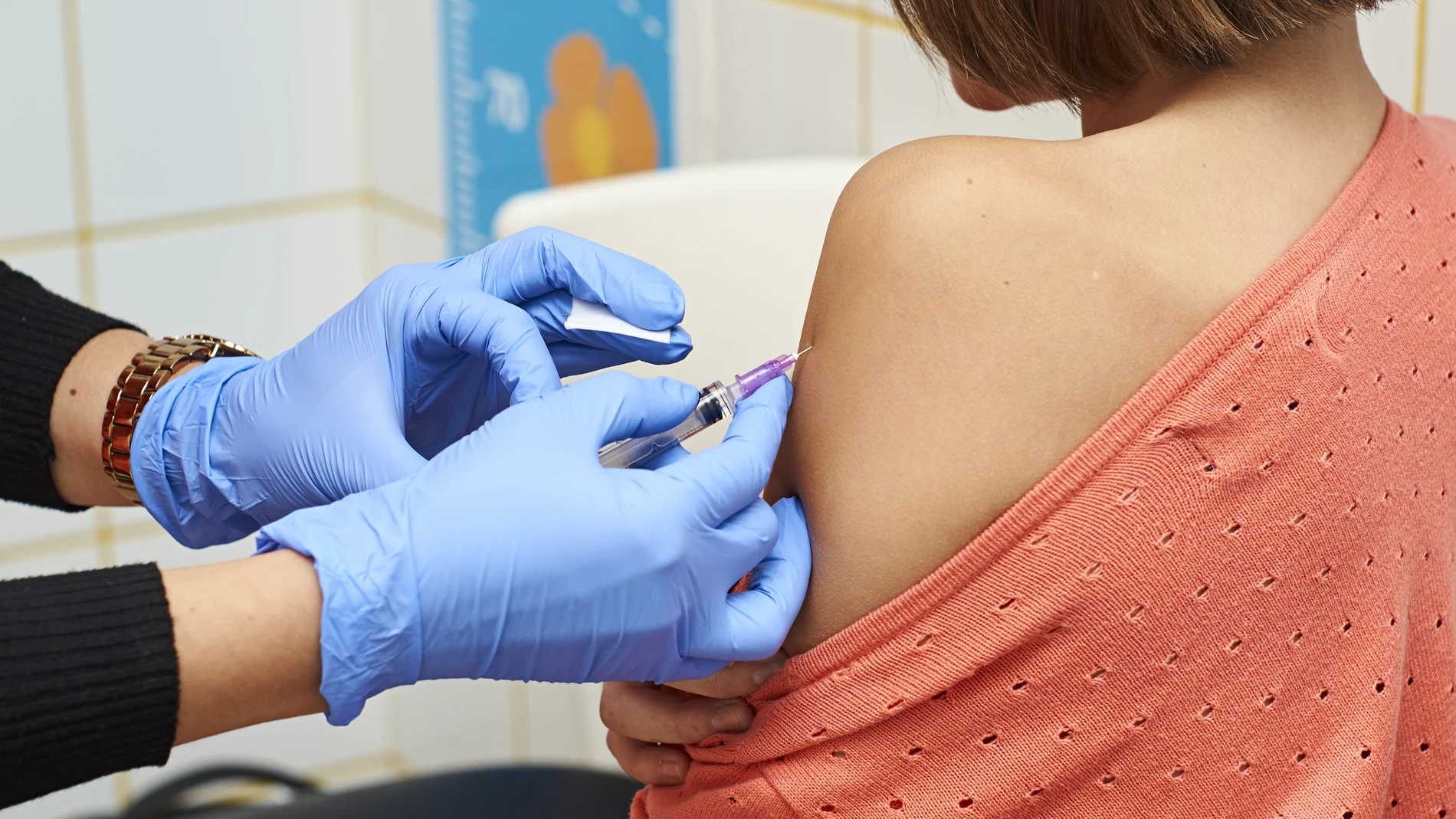
Moderna comenzará a evaluar la eficacia y seguridad de su vacuna contra la Covid en adolescentes de 12 a 17 años, según se recoge en el portal de ensayos clínicos de Estados Unidos (clinicaltrials.gov) y ha adelantado «The New York Times». El estudio incluirá a 3.000 adolescentes, de los que la mitad recibirá dos inyecciones de la vacuna con cuatro semanas de diferencia y la otra mitad placebo. El ensayo «aún no está reclutando» a participantes y todavía no hay una fecha de inicio.
Los ensayos fase 3 en adultos de la compañía han arrojado una eficacia de su vacuna cercana al 94%. En base a estos resultados, podría ser aprobada en EE UU a mediados de mes y en Europa el 12 de enero. Sin embargo, aún no ha sido estudiada en niños.
Generalmente, las vacunas destinadas tanto a adultos como a niños se prueban primero en adultos para ayudar a asegurar que son seguras para los ensayos pediátricos. La vacuna tampoco ha sido testada en embarazadas. El medio americano avanza que en este nuevo ensayo clínico las niñas que han pasado la pubertad serán analizadas antes de cada inyección para asegurarse de que no están embarazadas. Pfizer comenzó a probar su vacuna contra el coronavirus en niños de 12 años en octubre. AstraZeneca también ha realizado ensayos en esta población pediátrica.
En la carrera por su utilización, las dosis de vacuna llegarán en «horas y no días» al Reino Unido de cara al comienzo de la vacunación a partir de principios de la próxima semana después de que los reguladores británicos dieran luz verde al preparado. Se espera que los ancianos que viven en residencias y el personal que les cuida sean los primeros en recibir esta vacuna la próxima semana, a los que seguirán otros grupos vulnerables de la población. La Sanidad de ese país aún no ha decidido si emitirá certificados de la vacuna una vez que una persona ha sido inmunizada contra el coronavirus.
La Comisión Europea, por su parte, anunció ayer que acelerará todos los plazos para poder autorizar en apenas tres días la comercialización de una vacuna contra la Covid-19 desde el momento en que haya recibido el visto bueno científico de la Agencia Europea del Medicamento (EMA), de forma que puedan empezar a distribuirse en la UE a principios de enero.
Según han explicado fuentes comunitarias, el Ejecutivo tarda unos 67 días en autorizar una vacuna o fármaco en condiciones normales, pero la urgencia provocada por la pandemia ha obligado a Bruselas a usar toda la «flexibilidad» prevista en la normativa comunitaria para casos de urgencia. Así, este proceso se reducirá a «alrededor de tres días» gracias a dos elementos: en primer lugar, se limitará a un día el periodo de consultas con los Estados miembros que normalmente se prolonga durante 22; y en segundo lugar, se procederá a la traducción de la autorización a todos los idiomas oficiales de la UE después de que haya sido adoptada y no antes.
Con estos plazos sería posible que la autorización para la comercialización condicional de la primera vacuna llegara a principios de enero puesto que la EMA ya ha anunciado que prevé emitir su recomendación sobre la vacuna de Pfizer y BioNTech como muy tarde el 29 de diciembre.
Moscú, mañana ya
Mañana comenzará en Moscú la campaña masiva de la vacuna contra el coronavirus Sputnik V con la administración de las primeras dosis para las personas de grupos de alto riesgo. Moscú es el epicentro de la pandemia en Rusia, un país que lleva varios días marcando cifras máximas de contagios, con registros por encima de los 25.000 positivos en algunas jornadas. Precisamente la Sputnik V será la utilizada en Argentina para vacunar a 300.000 personas antes de final de año, mientras que se estima que se abarcará a otros 10 millones entre enero y febrero próximos. La de Pzifer podrá estar aplicándose en febrero y la de AstraZeneca y Oxford en marzo.
✕
Accede a tu cuenta para comentar


