
Ciencia
¿Por qué se descarga la batería del coche si no se usa?
Todo es cuestión de las reacciones químicas que se producen en su interior

En estos cambios de fase, muchos habrán querido aprovechar para coger por primera vez el coche tras tenerlo meses abandonado. Y en ese momento se habrán dado cuenta de una desagradable sorpresa: la batería estaba agotada.
Ya lo habrá oído de boca de un mecánico en algún momento: los coches necesitan encenderse cada cierto tiempo. Si permanece demasiado tiempo aparcado, la batería se va descargando hasta necesitar una recarga. Sabemos la práctica, pero nos podemos preguntar por la teoría. ¿Por qué sucede esto? Para entenderlo, tendremos que hablar sobre la química de nuestras baterías, algo que nos ayudará a entender mejor cómo usarlas.
Introducción a las pilas y baterías
Pueden existir muchos tipos diferentes de pilas y baterías, como las presentes en los teléfonos móviles o en los coches. Su funcionamiento y composición son muy diferentes entre sí, pero todas tienen algo en común: son capaces de aprovechar diferentes reacciones químicas para generar una corriente eléctrica.
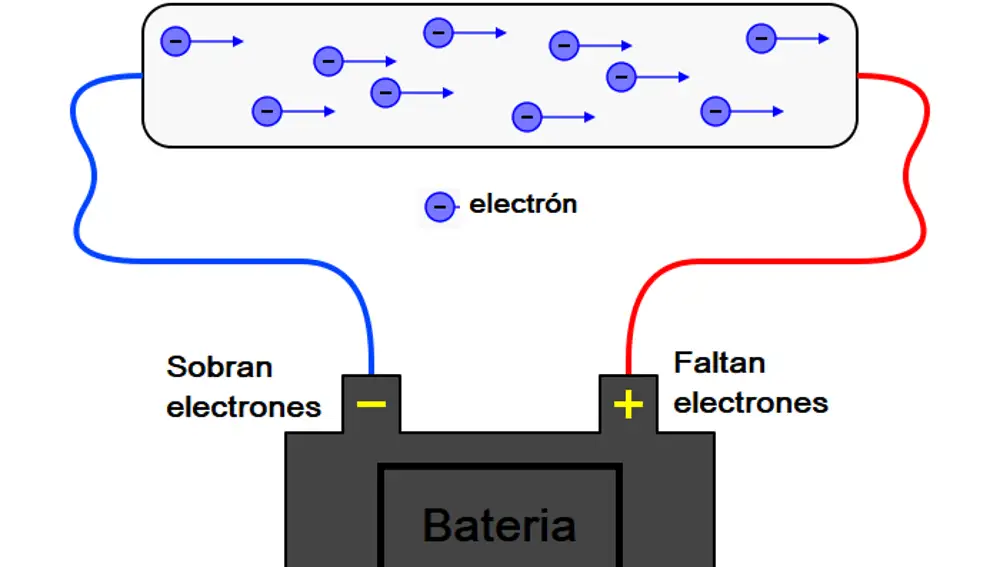
Para entenderlo, debemos recordar que lo que llamamos corriente eléctrica es realmente el movimiento de los electrones de un punto a otro a través de un material. Los electrones son partículas negativas que pueden viajar entre los átomos de materiales conductores como el metal, y los dispositivos electrónicos son capaces de aprovechar su energía para funcionar, ya sea la pantalla del teléfono móvil o la chispa que necesita un motor de gasolina para encenderse.
Los materiales conductores sirven de autopista para el paso de estos electrones, pero no generan la propia corriente. Para que se produzca, es necesario que se cumplan ciertas condiciones: en un extremo del material debe haber un exceso de electrones, y en el otro extremo una falta de ellos. Esta situación provocará que los electrones de más se desplacen y vayan a rellenar el hueco, generando una corriente eléctrica por el circuito. A mayor intensidad de corriente, más electrones estarán moviéndose al mismo tiempo, y más energía aportarán.
Para lograrlo, las baterías tienen dos electrodos, uno positivo llamado cátodo, y uno negativo llamado ánodo. Estos electrodos forman la parte visible de las pilas y las baterías, y es a la que debemos conectar los cables para obtener corriente. Pero también hay otro componente, situado en la parte interna de pilas y baterías que no llegamos a ver nunca, llamado electrolito, que puede ser sólido o líquido.
Los dos electrodos están formados por compuestos que reaccionan químicamente con el electrolito, pero según el electrodo que miremos, se producen reacciones inversas. En el ánodo se producen reacciones de oxidación, que generan un exceso de electrones. En el cátodo, se producen reacciones de reducción, que recogen electrones. Si conectamos el ánodo y el cátodo de una batería a un circuito, las reacciones químicas de ambos electrodos se producen y generamos una corriente eléctrica.
A medida que se produce la reacción química en el electrodo, los compuestos químicos que llevan se transformarán en otros diferentes, y llegará un punto en el que no quede nada más y la reacción química se detenga. Es en ese momento cuando decimos que una batería o pila se ha agotado.
En las pilas o baterías irreversibles, los compuestos químicos finales son estables o se han desprendido del electrodo, y no hay más remedio que desechar la pila. Merece la pena no tirarla a la basura y buscar puntos de recogida debido precisamente a esos compuestos químicos finales, que suelen ser poco respetuosos con el medio ambiente.
Pero también se han creado pilas y baterías recargables. En ellas, la reacción química de los electrodos es reversible, y los compuestos químicos que se quedan al final pueden volver a reaccionar y formar los originales si nosotros añadimos electrones, es decir, una corriente eléctrica, en la dirección contraria.
Las reacciones químicas reversibles han sido clave en el desarrollo de las baterías modernas, pero la recarga nunca es perfecta. El electrodo nunca vuelve a estar como al comienzo tras una recarga, y siempre queda una parte de este que no se recupera. Esto provoca que la pila o batería dure menos a medida que se recarga más veces.
Tras este resumen básico sobre baterías. Ya tenemos las bases para la duda que queremos resolver: ¿Por qué se agota la batería del coche si no lo usamos? Ahora podemos formularla de otra manera. ¿Qué es lo que pasa dentro de la batería del coche?
En su electrodo era espectacular
Las baterías de coche son del tipo plomo-acido. Se llaman así por los materiales que la componen. El electrolito es una disolución de ácido sulfúrico en el que están sumergidos los electrodos, hechos de plomo. Los cátodos positivos están cubiertos o impregnados de dióxido de plomo, y los ánodos negativos están formados por plomo esponjoso puro.
El dióxido de plomo del cátodo es capaz de absorber electrones al reaccionar el ácido sulfúrico, generando sulfato de plomo. Mientras, en el ánodo, el ácido sulfúrico reacciona con el plomo para generar sulfato de plomo y un exceso de electrones. De este modo, cada electrodo genera o absorbe electrones y puede formar la corriente.
En ambos casos el producto final de la reacción es el mismo: sulfato de plomo. Este se acumula en forma de cristales encima de los electrodos a medida que la batería funciona. También se libera agua y desaparece ácido sulfúrico puro, por lo que es posible conocer el estado de carga de una batería midiendo el pH del electrolito de su interior.
Como dijimos anteriormente, estas reacciones químicas son reversibles. Si le aportamos una corriente eléctrica a los electrodos, el sulfato de plomo acumulado vuelve a reaccionar y los cristales desaparecen, recuperando los electrodos originales. Pero esta reacción deja de ser útil si los cristales son demasiado grandes, porque la reacción solo se produce alrededor del electrodo y no logra disolverlo del todo. En ese momento, la batería deja de ser recargable y se dice que esta sulfatada (por el exceso de sulfato de plomo).
Cuando la batería está desconectada, estas reacciones químicas en los electrodos siguen produciéndose, pero mucho más lentamente. El exceso de electrones de un electrodo y la falta del otro acaban ralentizando las reacciones químicas, pero no llegan a desaparecer del todo. Si quedan cristales de sulfato de plomo en los electrodos, seguirán acumulándose y creciendo lentamente.
Para evitarlo, es necesario que la batería se recargue cada poco tiempo, y que los cristales no lleguen a crecer demasiado. Y para hacerlo, usamos nuestro propio coche. Cuando nos desplazamos en él, se activa una dinamo o un alternador conectado a la batería y que le suministra una pequeña corriente eléctrica suficiente para recargarla.
Hace falta que el coche se mueva, pero no necesariamente por estar encendido. Por eso podemos recargarla empujando el coche lo suficiente como para que la dinamo se active y poder eliminar el exceso de sulfato de plomo de los electrodos.
Normalmente estos pequeños procesos de carga y descarga pasan desapercibidos, pero si no cogemos el coche durante demasiado tiempo o usamos demasiado la batería, corremos el riesgo de que se descargue del todo y la reacción química deje de ser reversible.
Otro detalle interesante en este sentido es que la temperatura exterior afecta a estas reacciones químicas. En invierno, el sulfato de plomo cristaliza más fácilmente y la batería se descarga antes. Suele ser un fenómeno que pasa desapercibido si cogemos el coche a menudo, porque el propio calor del coche calienta la batería y vamos recargándola poco a poco. Pero en estas circunstancias pueden agravar el problema. En verano, las baterías aguantan más tiempo, aunque pueden tener otros problemas de corrosión o erosión debido a la temperatura. Por eso es difícil almacenar baterías de coche durante demasiado tiempo o se vuelven peligrosas.
En resumen, si su batería se ha sulfatado, con suerte los cristales seguirán siendo pequeños tras esta cuarentena y un pequeño empujón del coche bastará para activar la dinamo y hacerlo arrancar. Si no consigue activar las reacciones químicas de la batería de manera artesanal, llame a un mecánico. Pero nunca, nunca, mire dentro de su batería.
QUE NO TE LA CUELEN:
- De manera activa se buscan nuevos materiales y reacciones químicas para fabricar pilas y baterías más potentes. Sin cambiar de material, la única manera de acumular más potencia es usando electrodos más grandes. De hecho, de ahí viene el nombre de estos dispositivos: las pilas acumulan carga eléctrica al unirse de manera apilada, y las baterías al unirse en batería.
- Los coches eléctricos actuales tienen baterías de plomo-acido, con una distribución diferente de los electrodos y el medio, pero basadas en la misma reacción química. Por eso, se dice que es casi lo único que tiene en común un coche de gasolina y uno eléctrico.
REFERENCIAS:
✕
Accede a tu cuenta para comentar


