
Tecnología
Crean un implante pequeño y flexible que alivia el dolor a demanda y sin uso de opioides, ¿cómo funciona?
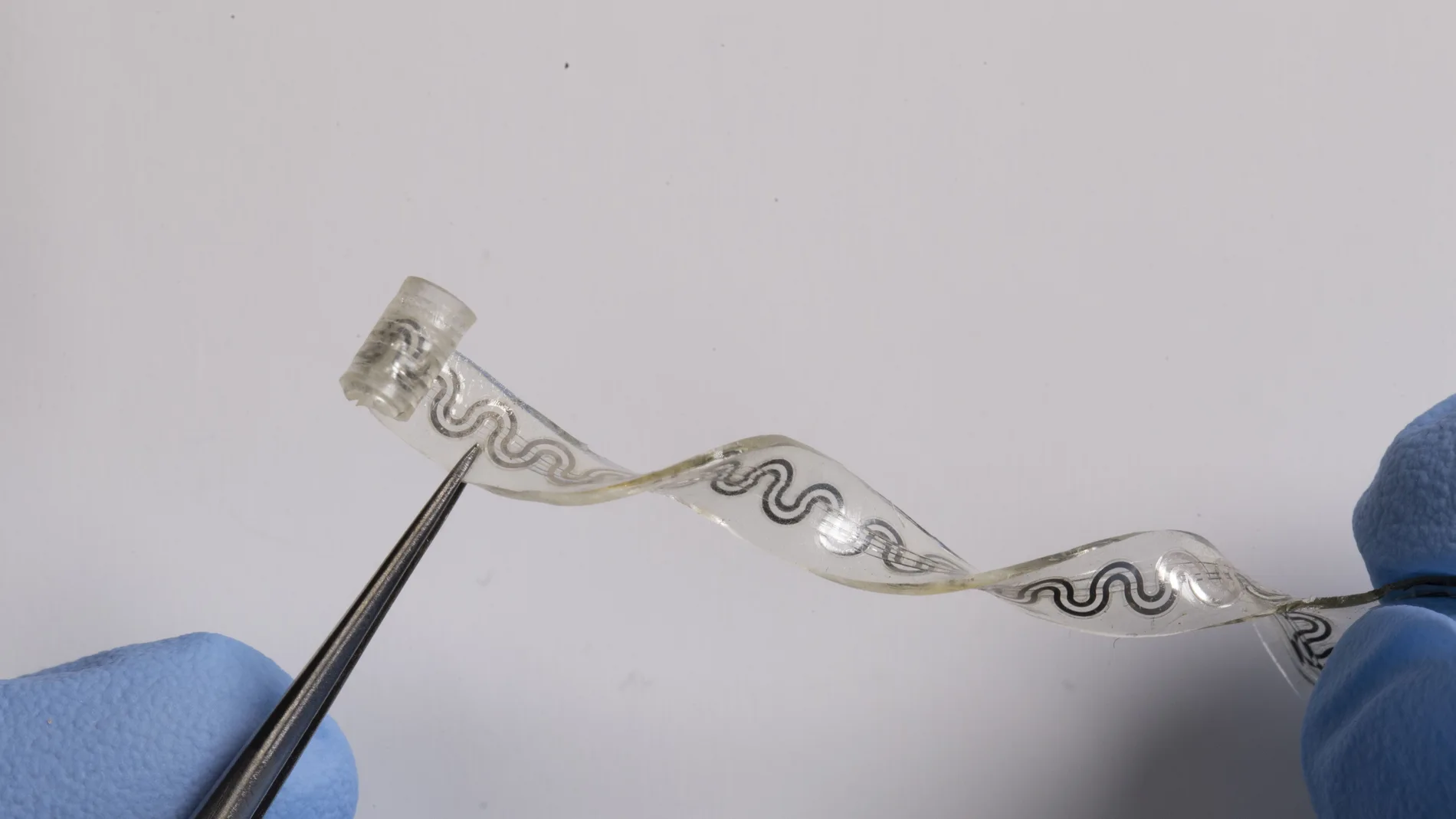
Un equipo de investigadores dirigido por la Universidad de Northwestern, en el estado de Illinois, ha desarrollado un implante pequeño, blando y flexible que alivia el dolor a demanda y sin necesidad de usar medicamentos.
Este dispositivo, publicado en la revista “Science”, podría proporcionar una alternativa muy necesaria a los opioides y otros medicamentos altamente adictivos. El documento describe el diseño del dispositivo y demuestra su eficacia en un modelo animal.
En concreto, se trata de un dispositivo biocompatible y soluble en agua funciona envolviendo los nervios para brindar un enfriamiento preciso y específico que adormece los nervios y bloquea las señales de dolor al cerebro.
Una “bomba” externa permite al usuario activar el dispositivo de forma remota y luego aumentar o disminuir su intensidad.
Una vez que ya no se necesita el dispositivo, se absorbe naturalmente en el cuerpo sin necesidad de extracción quirúrgica.
Los investigadores creen que el dispositivo resultará de gran ayuda para los pacientes que se someten a cirugías de rutina o incluso amputaciones que comúnmente requieren medicamentos postoperatorios, ya que los cirujanos podrían implantar el dispositivo durante el procedimiento para ayudar a controlar el dolor postoperatorio del paciente.
“Aunque los opioides son extremadamente efectivos, también son extremadamente adictivos”, recuerda John A. Rogers de Northwestern , quien dirigió el desarrollo del dispositivo.
“Como ingenieros, estamos motivados por la idea de tratar el dolor sin medicamentos, en formas que se puedan activar y desactivar instantáneamente, con el control del usuario sobre la intensidad del alivio que necesita. La tecnología que se informa aquí explota mecanismos que tienen algunas similitudes con los que hacen que los dedos se sientan entumecidos cuando están fríos. Nuestro implante permite que ese efecto se produzca de forma programable, directa y localmente en los nervios específicos, incluso en los que se encuentran en lo profundo de los tejidos blandos circundantes”, precisa Rogers, pionero de la bioelectrónica, profesor en la Escuela de Ingeniería McCormick y en la Escuela de Medicina Feinberg de la Universidad Northwestern, así como director fundador del Instituto Querrey Simpson de Bioelectrónica.
Cómo funciona
Aunque el nuevo dispositivo puede parecer ciencia ficción, aprovecha la evaporación. De manera similar a cómo el sudor evaporado enfría el cuerpo, el dispositivo contiene un refrigerante líquido que se induce a evaporarse en la ubicación específica de un nervio sensorial.
“A medida que se enfría un nervio, las señales que viajan a través del nervio se vuelven cada vez más lentas y eventualmente se detienen por completo”, afirma el coautor del estudio, el Dr. Matthew MacEwan, de la Facultad de Medicina de la Universidad de Washington en St. Louis.
“Nos dirigimos específicamente a los nervios periféricos, que conectan el cerebro y la médula espinal con el resto del cuerpo. Estos nervios que comunican los estímulos sensoriales, incluido el dolor. Al brindar un efecto de enfriamiento a solo uno o dos nervios específicos, podemos modular de manera efectiva las señales de dolor en una región específica del cuerpo”, añade.
Para inducir el efecto de enfriamiento, el dispositivo contiene diminutos canales de microfluidos. Un canal contiene el refrigerante líquido (ácido perfluoro pentanoico), que ya está clínicamente aprobado como agente de contraste de ultrasonido y para inhaladores presurizados. Un segundo canal contiene nitrógeno seco, un gas inerte.
Cuando el líquido y el gas fluyen hacia una cámara compartida, ocurre una reacción que hace que el líquido se evapore rápidamente. Simultáneamente, un pequeño sensor integrado monitorea la temperatura del nervio para asegurarse de que no se enfríe demasiado, lo que podría causar daño al tejido.
“El enfriamiento excesivo puede dañar el nervio y los tejidos frágiles que lo rodean”, explica Rogers en el comunicado del estudio.
“Por lo tanto, la duración y la temperatura del enfriamiento deben controlarse con precisión. Al monitorear la temperatura en el nervio, las tasas de flujo se pueden ajustar automáticamente para establecer un punto que bloquee el dolor de manera segura y reversible. El trabajo en curso busca definir el conjunto completo de umbrales de tiempo y temperatura por debajo de los cuales el proceso sigue siendo completamente reversible”, añade.
Desaparición
Esta nueva tecnología es el tercer ejemplo de dispositivos electrónicos bioabsorbibles del laboratorio de Rogers, que introdujo el concepto de electrónica transitoria en 2012.
En 2018, Rogers, MacEwan y sus colegas demostraron el primer dispositivo electrónico bioabsorbible del mundo, un implante biodegradable que acelera la regeneración nerviosa, publicado en “Nature Medicine”. Luego, en 2021, Rogers y sus colegas introdujeron un marcapasos transitorio , publicado en “Nature Biotechnology”.
Todos los componentes de los dispositivos son biocompatibles y se absorben naturalmente en los biofluidos del cuerpo en el transcurso de días o semanas, sin necesidad de extracción quirúrgica. Los dispositivos bioabsorbibles son completamente inofensivos, aseguran los investigadores.
✕
Accede a tu cuenta para comentar




