Medicamentos
EE UU aprueba un fármaco español para el cáncer de pulmón más agresivo
La FDA da el visto bueno a lurbinectedina, de PharmaMar, frente al tumor de célula pequeña en primera línea de mantenimiento
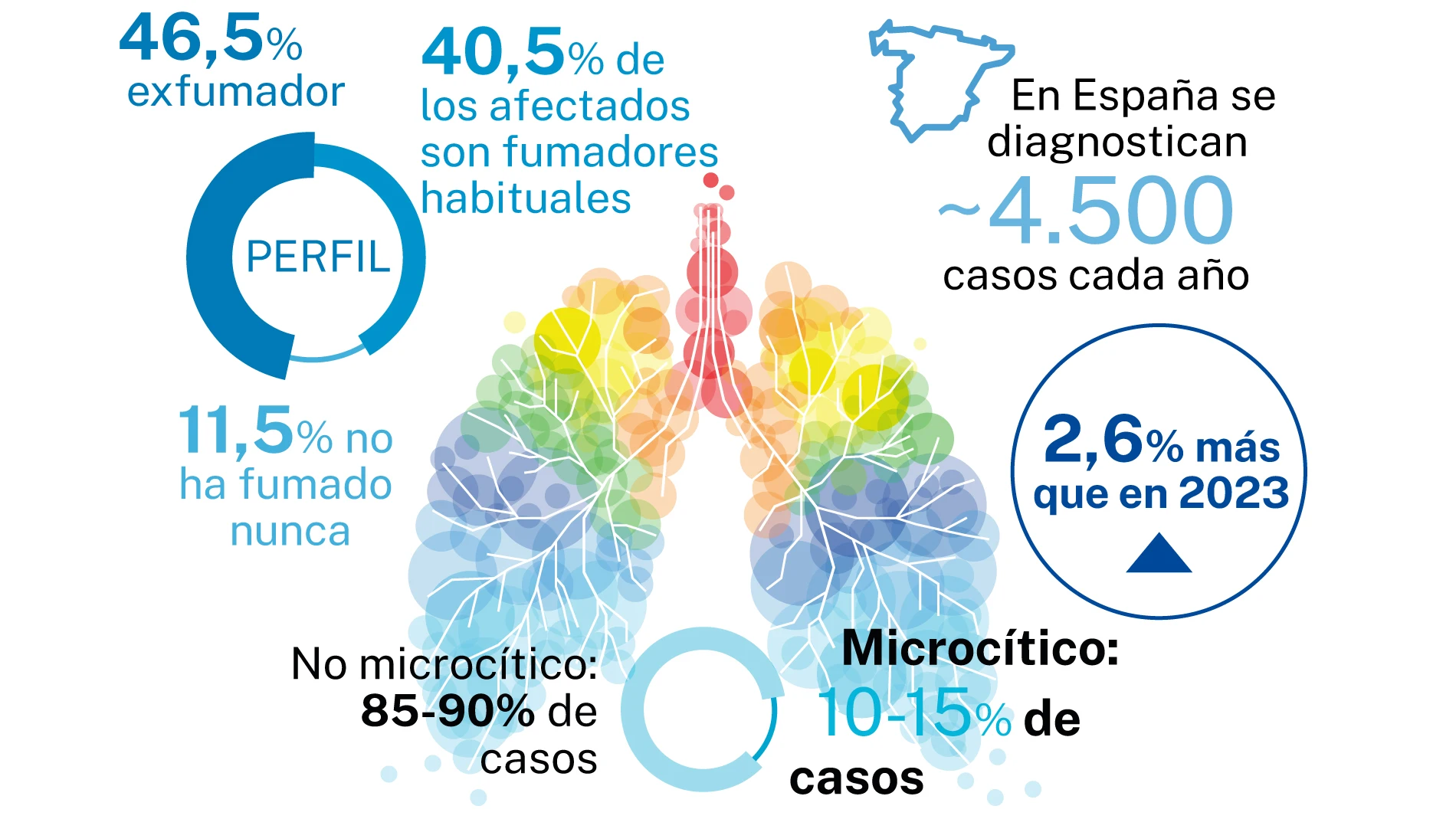
Un medicamento español y desarrollado por una compañía farmacéutica española podrá ser utilizado en Estados Unidos por los pacientes con cáncer de pulmón de célula pequeña (CPCP) tras recibir el visto bueno de la Agencia Americana del Medicamento (FDA, por sus siglas en inglés). Todo un hito para la ciencia nacional y para una enfermedad tan compleja como esa.
Hablamos de lurbinectedina, (comercializado como Zepzelca por PharmaMar), que podrá usarse en combinación con atezolizumab (Tecentriq) como tratamiento en primera línea de mantenimiento para adultos con CPCP en estadio avanzado, cuya enfermedad no ha progresado tras el tratamiento de inducción de primera línea con atezolizumab, carboplatino y etopósido.
«Este hito refleja el talento, la capacidad científica y la excelencia de la investigación biomédica española. Nos sentimos profundamente orgullosos de contribuir, desde España, a ofrecer nuevas soluciones frente al cáncer a pacientes de todo el mundo. En PharmaMar, además, llevamos más de dos décadas siendo pioneros en la investigación del CPCP, una de las patologías más complejas en Oncología –señala Javier Jiménez, Chief Medical Officer de PharmaMar–. Tras ello, nuevas líneas de investigación y de conocimiento de la patología han sido posibles avanzando así hacia nuestro objetivo principal: que los pacientes dispongan de más y mejores opciones terapéuticas».
Hito
Y es que con la aprobación, se convierte en la primera terapia combinada para el tratamiento en primera línea de mantenimiento para CPCP en estadio avanzado, un cáncer agresivo y de rápido crecimiento para el que existen limitadas opciones terapéuticas actualmente.
Tanto es así, que la Red Nacional de Cáncer Integral (NCCN) ha actualizado recientemente sus guías de práctica clínica en Oncología en este tipo de tumor para incluir la combinación como la opción preferida para pacientes cuya enfermedad no ha progresado tras cuatro ciclos de inducción con quimioterapia basada en platino y atezolizumab.

«La posibilidad de incorporar esta combinación de fármacos en primera línea de mantenimiento nos permite ofrecer una opción terapéutica antes y a más pacientes con CPCP en estadio avanzado, un grupo de pacientes con importantes necesidades médicas no cubiertas. En particular, para aquellos en estadio avanzado, que tras completar el tratamiento inicial afronta un periodo de gran incertidumbre dado el alto riesgo de progresión y esta es la primera vez que una intervención en este periodo demuestra retrasar la progresión de la enfermedad, y como consecuencia, ampliar la supervivencia. Es un paso adelante en nuestro compromiso con los pacientes y familiares», explica Jiménez.
La mediana de supervivencia global para la combinación fue de 13,2 meses frente a 10,6 meses
La aprobación de la FDA está basada en los resultados del ensayo de fase 3 IMforte que demostró que la combinación de lurbinectedina con atezolizumab redujo el riesgo de progresión de la enfermedad o muerte en un 46% y el riesgo de muerte en un 27%, en comparación con atezolizumab en monoterapia en mantenimiento.
Tras cuatro ciclos de terapia de inducción, desde la aleatorización, la mediana de supervivencia global para el régimen combinado fue de 13,2 meses frente a 10,6 meses. Desde el momento de la aleatorización, la mediana de supervivencia libre de progresión según la evaluación independiente fue de 5,4 meses frente a 2,1 meses.
La seguridad fue coherente con los perfiles de seguridad conocidos de ambos tratamientos. Los resultados se presentaron en la reunión anual de 2025 de la Sociedad Americana de Oncología Clínica (ASCO) y se publicaron simultáneamente en la revista científica «The Lancet».
A la espera de la EMA
PharmaMar también ha presentado una solicitud de autorización de comercialización a la Agencia Europea de Medicamentos (EMA), que actualmente se encuentra en proceso de revisión. Y es que se da la circunstancia de que en la Unión Europea, sin embargo, sigue sin estar disponible en ninguna línea. De hecho, únicamente está aprobada en Suiza y en segunda línea.
A día de hoy, lurbinectedina ya está aprobada en 20 territorios en segunda línea de tratamiento, si bien esta es la primera aprobación como primera línea, lo que permitirá llegar antes a más pacientes.
«La aprobación de esta combinación por parte de la FDA refuerza, una vez más, la visión que en PharmaMar mantenemos desde hace décadas: el potencial del mar como fuente de innovación terapéutica. Este hito internacional para los pacientes confirma que nuestro modelo de investigación está a la altura de los grandes referentes globales en Oncología», concluye Jiménez.
✕
Accede a tu cuenta para comentar