
Para evitar escasez
La EMA supervisará los stocks de fármacos contra monkeypox
Las autoridades sanitarias de la UE han dado luz verde a dos productos para tratar esta enfermedad
La Unión Europea ha aprendido, gracias a la pandemia del coronavirus, la importancia de coordinar sus políticas sanitarias nacionales. Por eso, la Agencia Europea del Medicamento (EMA por sus siglas en inglés) va a elaborar una lista de los medicamentos fundamentales para luchar contra la viruela del mono, después de que la Organización Mundial de la Salud (OMS), declarase la semana pasada la alerta máxima por el aumento de casos en el mundo.
Según ha explicado la EMA, las autoridades encargadas de las autorizaciones de comercialización de medicamentos estarán obligadas a partir de ahora a informar al organismo europeo sobre sus existencias y las previsiones de oferta y demanda, con el objetivo de estar preparados y evitar situaciones de escasez. Además, los Estados miembros también deberán compartir estos datos en aras de que la EMA pueda coordinar las acciones apropiadas. Nadie quiere que vuelvan a repetirse los mismos episodios del comienzo de la pandemia del coronavirus en la primavera de 2020, cuando la escasez de productos médicos de primera necesidad como mascarillas y test hizo que algunos países incluso llegaran a bloquear las exportaciones y las «zancadillas» para hacer acopio de este material se convirtieron en la práctica dominante.
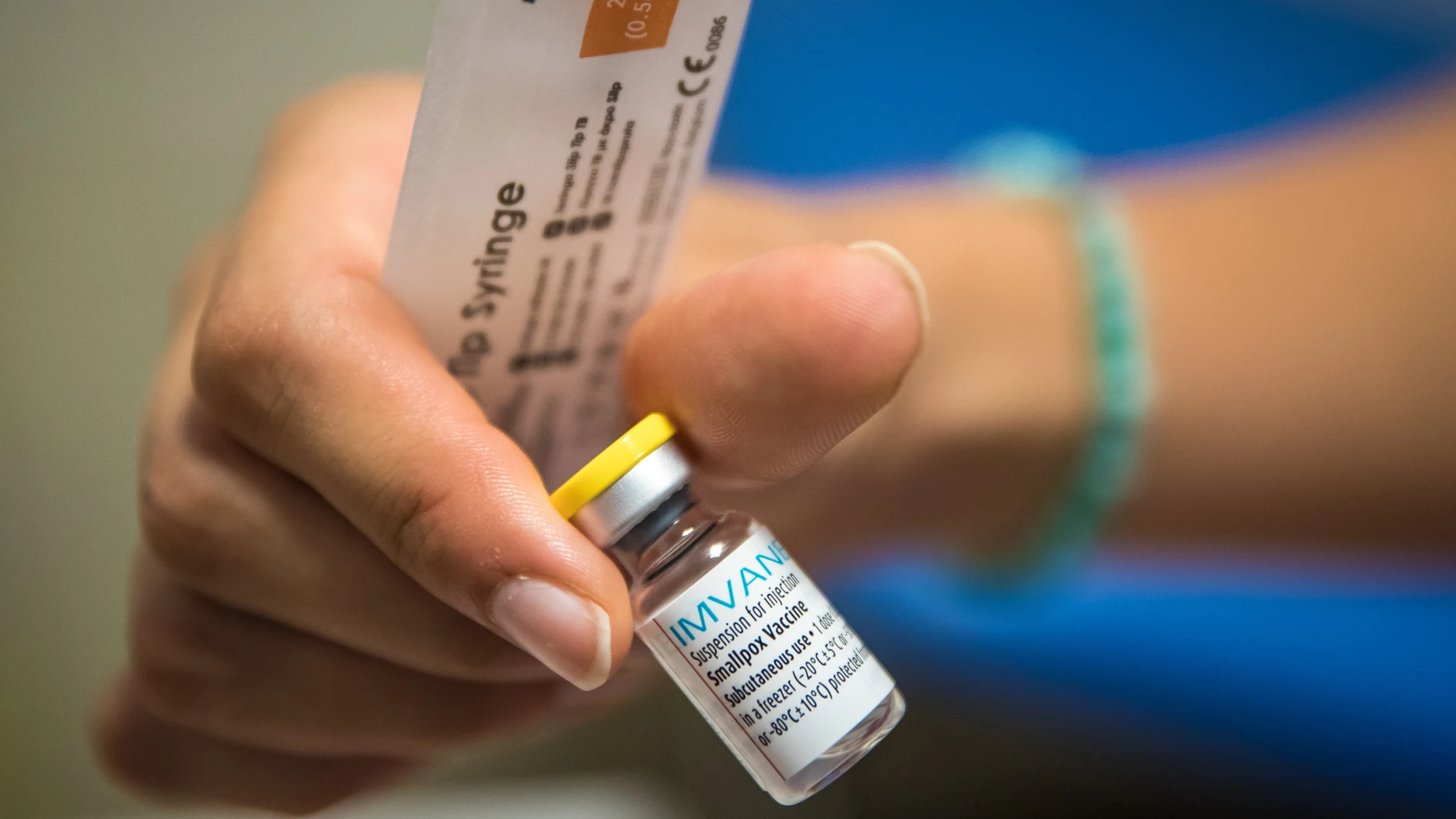
Todo indica que la UE está aprendiendo de sus errores. La Comisión Europea anunció hace unas semanas la compra de 109.090 dosis de la vacuna desarrollada por el laboratorio Bavarian Nordic, conocida como Imvanex ,para hacer frente a esta enfermedad.
Esta primera tanda de viales ya ha comenzado a repartirse de manera proporcional entre los países europeos según la población y el mayor número de casos contabilizados en el momento de la firma del contrato.
En realidad, este antídoto fue concebido para luchar contra la viruela, pero su tecnología de tercera generación hace pensar a los expertos que será eficaz también para hacer frente a esta nueva variante, lo que ha hecho que la EMA haya acabado autorizando su comercialización.
Aunque en el pasado era normal que toda la población fuera inmunizada contra la viruela corriente, su erradicación ha hecho que en los últimos años las personas menores de 40 años no hayan recibido este antídoto. El último caso conocido de viruela tuvo lugar en 1977, lo que llevó a que en 1980 las autoridades sanitarias declarasen de manera oficial que esta enfermedad habíadesaparecido.
La adquisición de los viales se ha realizado a través de la Autoridad Europea de Preparación y Respuesta ante Emergencias (HERA por su siglas en inglés), un nuevo organismo creado en octubre de 2021 para evitar la fragmentación nacional en la toma de decisiones en el ámbito sanitario, tal y como sucedió durante la primera etapa de la crisis del coronavirus, hasta que la Comisión Europea auspició la compra centralizada de vacunas, a la que los países europeos se adhirieron de manera voluntaria. Ahora, tras la creación de HERA, es la primera vez que se está utilizando un programa del presupuesto comunitario para tal fin. Además, en la UE también se ha dado luz verde a la comercialización del medicamento Tecovirimat SIGA para tratar la enfermedad.
Asimismo, el grupo de trabajo de emergencia creado durante la pandemia del coronavirus (ETF por sus siglas en inglés) ha visto reforzado su mandato para también coordinar los esfuerzos en relación a la viruela del mono.
✕
Accede a tu cuenta para comentar

Riesgo de escalada




