Farmacia
Lecanemab: así funciona el medicamento que frena el avance del alzhéimer y acaba de aprobar EE UU
La FDA ha dado luz verde a la comercialización del fármaco que la compañía japonesa Eisai ha estado investigando junto a la estadounidense Biogen
La Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en inglés) aprobó el pasado 6 de enero el uso de un nuevo fármaco destinado a reducir el deterioro cognitivo en pacientes que padecen Alzhéimer. Se trata de un medicamento muy esperado tras el fallido lanzamiento de otro tratamiento, hace un año y medio. El nuevo fármaco, que será comercializado bajo el nombre de Leqembi, está recomendado para pacientes que aún no han alcanzado una etapa avanzada de la enfermedad.
El tratamiento está desarrollado por la compañía farmacéutica japonesa Eisai, en asociación con la estadounidense Biogen y se suministra por vía intravenosa una vez cada dos semanas. Este fármaco representa “un importante paso en nuestra batalla para tratar eficazmente la enfermedad de Alzhéimer”, que afecta a unos 6,5 millones de estadounidenses, dijo la FDA en un comunicado. Según un comunicado de Eisai, aproximadamente 100.000 personas podrían recibir el Leqembi en EE UU en los próximos tres años, dados los criterios de elegibilidad (deterioro cognitivo leve y confirmación de la presencia de placas amiloides).
¿Cómo funciona?
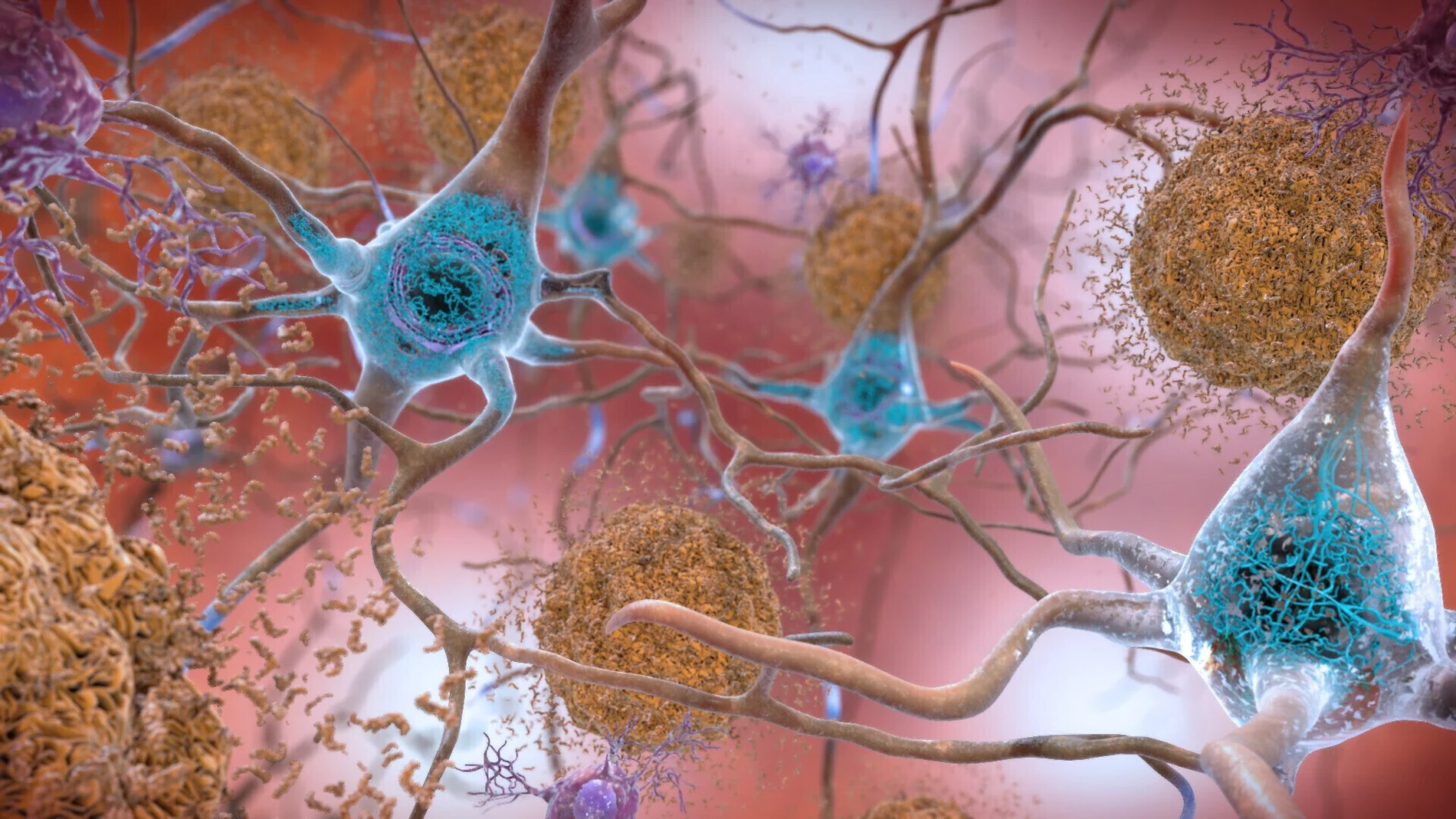
Leqembi, cuyo principio activo se llama lecanemab, ataca los depósitos de una proteína llamada beta-amiloide. Aunque la causa de la enfermedad de Alzhéimer sigue siendo poco conocida, los pacientes presentan placas amiloides en el cerebro, que se forman alrededor de las neuronas y finalmente las destruyen. Esto es lo que provoca la pérdida de memoria característica de la enfermedad. En las etapas posteriores, los pacientes ya no pueden realizar tareas diarias ni mantener conversaciones.
La autorización de la FDA se basa en los resultados de ensayos clínicos que mostraron que el medicamento ayudó a reducir las placas amiloides. La agencia también mencionó los resultados de ensayos clínicos más amplios, publicados recientemente la revista médica The New England Journal of Medicine y de los cuales la FDA espera recibir datos completos “pronto”.
Estos estudios comenzaron en marzo de 2019. Participaron 1.795 personas de Japón, Estados Unidos y Europa de entre 50 y 90 años con deterioro cognitivo (demencia) leve o alzhéimer en estadios tempranos con anomalías de beta amiloide (un péptido clave en su desarrollo) confirmadas. Los participantes fuerondivididos en dos grupos: unos recibieron una dosis de lecanemab cada 2 semanas durante 18 meses, mientras que al otro grupo se le dio un placebo, con el fin de investigar los cambios en sus funciones cognitivas.
Tras 18 meses, el grupo tratado con en nuevo fármaco presentó una reducción del 27 % en el empeoramiento de los síntomas comparado con el que recibió el placebo. Además, a partir de los seis meses “el tratamiento mostró cambios estadísticamente significativos” en la evolución cognitiva. Los receptores de lecanemab tuvieron un 31% menos de probabilidades de avanzar a la siguiente etapa de la enfermedad durante el estudio.
Graves efectos adversos
Los científicos confirmaron la eficacia del lecanemab, aunque también instaron a seguir investigando los posibles efectos adversos del tratamiento. De acuerdo con los datos publicados, el 17,3% de los pacientes tratados con lecanemab sufrieronhemorragias cerebrales,frente al 9% del grupo placebo. Y el 12,6% de las personas sufrieron edema cerebral, en comparación con solo el 1,7% en el grupo del placebo. La tasa de mortalidad fue casi la misma en los dos grupos (0,7% en las personas tratadas con lecanemab, 0,8% en las que recibieron placebo). En ese sentido, la FDA ha incluido una advertencia sobre el riesgo de sangrado en la información del medicamento.
Este es el segundo medicamento para el Alzhéimer aprobado recientemente por la FDA, después del Aduhelm en junio de 2021 (que usa una molécula llamada aducanumab). Producido también por las empresas Biogen y Eisai, y dirigido asimismo a las placas amiloides, fue el primer fármaco lanzado al mercado contra esta enfermedad en casi dos décadas. Sin embargo, Aduhelm no tuvo el éxito esperado. Su autorización estuvo rodeada de polémica, dado que algunos expertos criticaron la falta de pruebas sobre su eficacia. Además, los más críticos argumentaron que el fármaco no cura el alzhéimer ni lo revierte y que, al tratarse de un tratamiento intravenoso que puede costar hasta 50.000 dólares al año por paciente, se estaría, prácticamente, “tirando” un dinero que se puede emplear en otras muchas necesidades urgentes. Posteriormente, su uso quedó restringido a personas con casos moderados de la enfermedad.
✕
Accede a tu cuenta para comentar

Experiencias en el extranjero