
Graves demoras
Los nuevos fármacos tardan 517 días en llegar a los pacientes con el actual Gobierno
Son 132 días más que antes de la moción de censura. Los tratamientos contra el cáncer se incorporan con 469 días de retraso, 74 más que en 2018

Al grave problema estructural que sufre la sanidad pública española con las listas de espera quirúrgicas y diagnósticas–en niveles récord en el conjunto del país–, hay que sumar otro de consecuencias funestas para los pacientes: el retraso desmesurado en la llegada a los centros sanitarios de los nuevos medicamentos. Aunque viene de largo, este problema se ha agudizado también desde que Pedro Sánchez accedió al Gobierno tras resultar vencedor en la moción de censura contra Mariano Rajoy, a mediados de 2018.
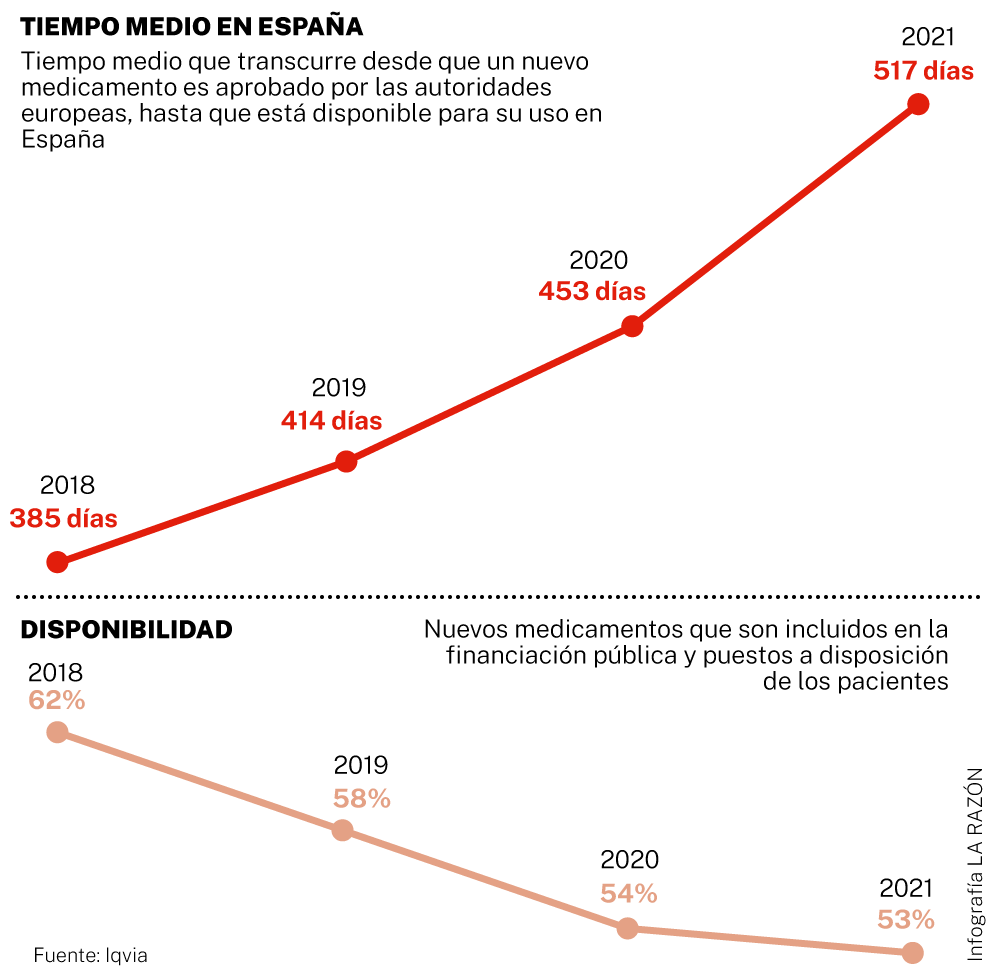
Los datos en poder de LA RAZÓN revelan que cuando el PP dejó el Ejecutivo como consecuencia de dicha moción, la incorporación de fármacos innovadores contra muchos tipos de enfermedades acumulaba un retraso medio de 385 días desde que los autorizaba la Agencia Europea del Medicamento (EMA, por sus siglas en inglés) o su homóloga en España. Tras la llegada de Pedro Sánchez a la Moncloa, el plazo se ha dilatado hasta los 517 días de media o, lo que es lo mismo, casi 1,5 años. Son, por tanto, 132 días más que los registrados al final del periodo anterior.
El informe anual «Indicadores de acceso a terapias innovadoras en Europa (WAIT Indicator)», elaborado por la consultora Iqvia para la Federación Europea de Asociaciones de la Industria Farmacéutica (Epfia), da fe de este retraso y soslaya que «el nivel de acceso a los nuevos tratamientos en España es inferior al de los países de nuestro entorno cercano», un problema que, apunta, «se agrava cada año».
Los datos de esta consultora especializada revelan en concreto que en el periodo 2017-2020 el tiempo medio que transcurría desde que un nuevo fármaco era aprobado por las autoridades regulatorias hasta que estaba disponible para su uso en Alemania era de apenas 133 días; en Francia, de 240 días; en Inglaterra, de 340 días, y en Italia, de 429 días. Todos ellos lejos de la marca alcanzada en España en 2020, que fue de 453 días, produciéndose otro gran salto hasta los 517 días justo un año más tarde.
Dicho retraso coincide básicamente con el tiempo en el que permaneció en el cargo de directora general de Farmacia del Ministerio de Sanidad Patricia Lacruz, muy cuestionada por todo el sector del medicamento en España. Lacruz fue relevada en el puesto por César Hernández, un reputado experto en materia de fármacos.
El estudio de Iqvia se centra también en lo que se denomina disponibilidad de los nuevos medicamentos, que es el número de los que se incluyen finalmente en la financiación pública y se ponen a disposición de los pacientes.
Según las conclusiones, el porcentaje en España es el más bajo de los grandes mercados europeos. En concreto, en España están disponibles 85 de los 160 fármacos aprobados en la Unión Europea (UE) en el periodo 2017-2020, periodo que coincide básicamente con el asentamiento de Pedro Sánchez en el poder.
En Alemania, la disponibilidad es del 92% de los fármacos autorizados en la UE –147 medicamentos–; En Italia, del 79% –127 medicamentos–; en Inglaterra, del 68% –108 fármacos–; y en Francia, del 66% –105 medicamentos–.
Por si fuera poco, España tiene también el mayor porcentaje de disponibilidad restringida, con un 41%. Esto que equivale a decir que del 53% de los medicamentos disponibles en nuestro país sobre el total de autorizados en Europa, cuatro de cada diez lo están en España con algún tipo de restricción de acceso. La disponibilidad restringida es muy inferior en otros países de Europa. En Alemania, apenas alcanza el 1%; en Italia, el 13%; en Francia, el 15%, y en Inglaterra, el 39%.
Aunque el retraso en la incorporación de nuevos medicamentos al mercado español es generalizado, el caso de algunos de ellos es especialmente dramático. Sobre todo para los pacientes que podrían beneficiarse de los tratamientos. Los ejemplos al respecto son abundantes.
El Nerlynx, del laboratorio Pierre Fabre, para el tratamiento adyuvante extendido de cáncer de mama en estadio inicial con receptor hormonal positivo, ha tenido que esperar 906 días para su incorporación desde que fue autorizado por la Agencia Española de Medicamentos y Productos Sanitarios. Zeposia, un fármaco de Bristol para la esclerosis múltiple remitente-recurrente con receptor hormonal positivo, tuvo que aguardar 736 días.
El medicamento Ontozry, de Angelini, para el tratamiento concomitante de las crisis de inicio focal con o sin generalización secundaria en adultos con epilepsia, que no han sido controladas de forma adecuada, hubo de hacerlo 456 días. El producto Evryski, de Roche, para la atrofia muscular espinal, tardó 620 días, y el Adakveo, de Novartis, dirigido a la prevención de las crisis vasoconclusivas recurrentes en pacientes de 16 años o mayores con enfermedad de células falciformes, tuvo que esperar 668 días.
Estos y otros retrasos han llevado a numerosas asociaciones de pacientes y a sociedades científicas a demandar una actuación más diligente por parte de las autoridades sanitarias. También las compañías farmacéuticas, agrupadas en la patronal Farmaindustria, han denunciado durante los últimos años la situación. Se da además la circunstancia de que una vez que son autorizados, los nuevos productos se topan con obstáculos en algunas autonomías e, incluso, en algunos hospitales de una comunidad.
✕
Accede a tu cuenta para comentar





