
Embarazo
Primer caso de gemelos libres del Síndrome de la Máscara
El equipo de Reproducción Asistida del Hospital Quirónsalud Barcelona ha conseguido el nacimiento, por primera vez en España, de dos pequeños libres de distrofia muscular hereditaria
El equipo de Reproducción Asistida del Hospital Quirónsalud Barcelona ha conseguido el nacimiento, por primera vez en España, de dos pequeños libres de distrofia muscular hereditaria
Los avances en el laboratorio no dejan de sorprender. Procesos que tienen su reprecusión en el ámbito de la clínica, es decir, en el día a día de la consulta médica. Al duro y complicado proceso de borrar las marcas de un ADN defectuso en un único embrión, el equipo de Repodrucción Asistida del Hospital Quirónsalud de Barcelona, liderado por el doctor Ramón Aurell, ha conseguido dar un paso más allá: el nacimiento de gemelos libres de una distrofia muscular hereditaria, conocida como Síndrome de la Máscara. Tras 35 semanas de gestación, los gemelos nacieron en perfecto estado de salud, evolucionan de forma adecuada y son genéticamente normales, tras su nacimiento en marzo de este año. En el proceso han intervenido, además de los médico ginecólogos y biólogos del centro condal, el equipo de genetistas de Reprogenetics. Su misión concreta era corregir la anomalía que transmitía el padre, enfermo tetraplégico y evitar transmitir a su descendencia sus posibles problemas de salud, por lo que se buscó un familiar que no tuviera problemas y que pudiera servir como modelo para encontrar los embriones más adecuados. Para tal fin se llevó a cabo un análisis de los blastocitos a los cinco días y posteriormente se repitió tres días después para aumentar la eficacia del procedimiento.
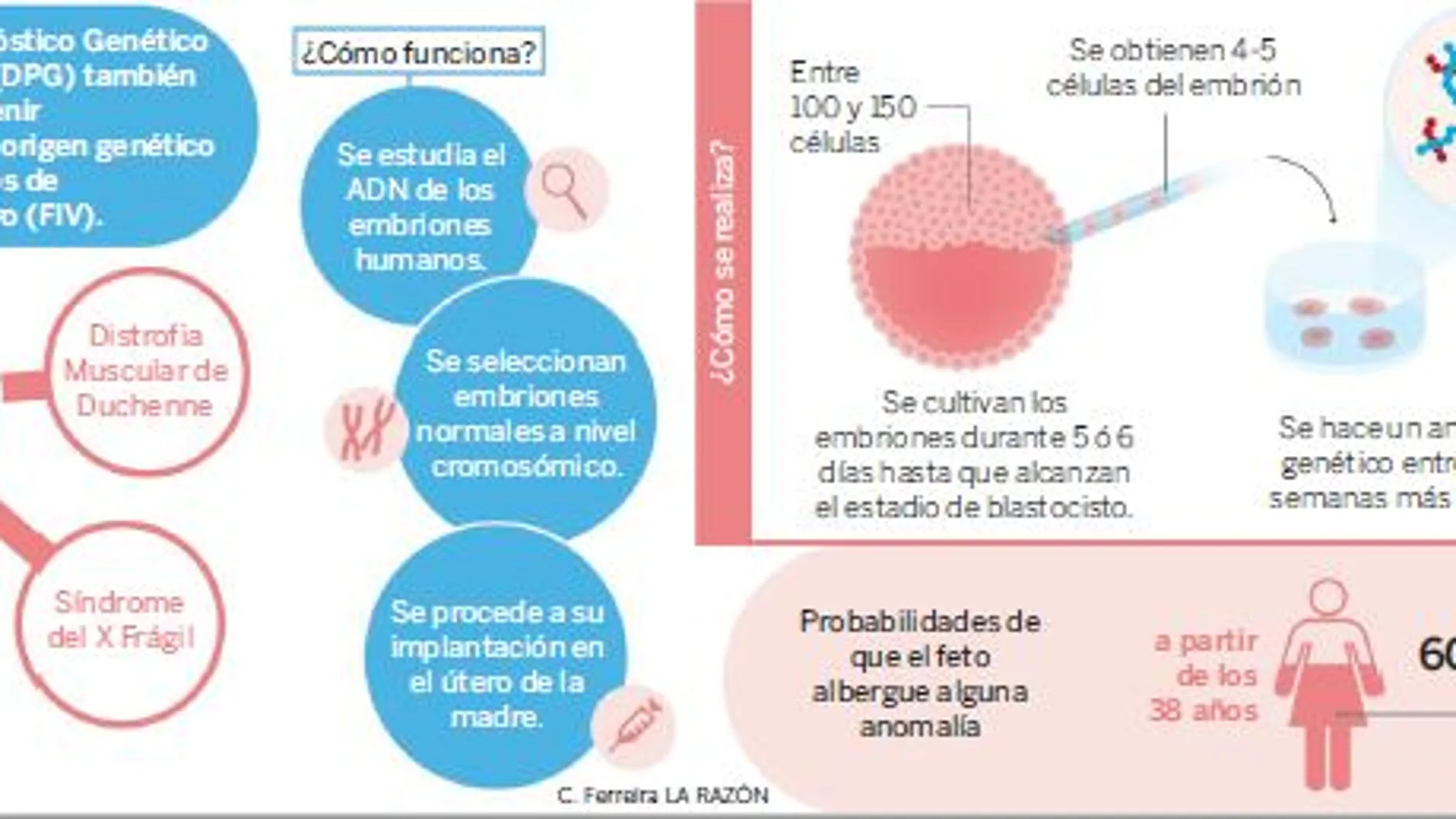
Aunque ésta no sería la única enfermedad que se podría borrar en los genes, como explica el doctor Aurell: «A fecha de hoy, hemos hecho casos de distrofia muscular de Duchenne, Síndrome del X Frágil, enfermedad de Milroy, otras distrofias musculares, pero podemos aplicar esta técnica a cualquier enfermedad genética grave de aparición precoz y sin tratamiento curativo postnatal, según recoge la Ley de Reproducción Asistida. Cualquier otra enfermedad que no cumpla los requisitos anteriores requiere autorización por parte de la Consejería de Sanidad de la comunidad autónoma correspondiente, así como un informe favorable de la Comisión Nacional de Reproducción Humana Asistida».
Antes del desarrollo de esta técnica, la única posibilidad que había era realizar el diagnóstico una vez que el feto ya estaba implantado en el útero. Si entonces se descubría que existían defectos genéticos, era preciso llevar a cabo un «aborto terapéutico». Esta nueva técnica evita estos problemas. En el caso que han abordado en el Hospital Quirónsalud de Barcelona, se ha conseguido esquivar el Síndrome de la Máscara que produce retraso mental constante, que puede ir de leve a moderado, además de un amplio espectro de trastornos neuromusculares, pudiendo incluso afectar en el desarrollo del individuo ocasionando una baja talla. Además de desencadenar posibles problemas visuales y auditivos, cardiopatías congénitas o hernia diafragmática entre otros problemas asociados con esta enfermedad.
El equipo del doctor Aurell ha empleado las ventajas del diagnóstico genético preimplantacional (DGP), que se utiliza de forma habitual con mujeres a partir de los 38 años que se quieren someter a técnicas de reproducción asistida. Con el fin de evitar y eliminar posibles defectos genéticos en los tratamientos de fecundación in vitro, se procede de forma protocolaria a llevar a cabo el DGP. Consiste en el estudio del ADN de los embriones humanos antes de proceder a su implantación en el útero de la madre, seleccionando aquellos que resultan cromosómicamente normales. Desde Reprogenetics, Carles Giménez, apunta que «cada una de las células obtenidas contiene una pequeña cantidad de ADN. Para poder estudiarlo, necesitamos aumentar (amplificar) dicha cantidad. Para ello se utilizan técnicas que amplifican todo el genoma hasta la cantidad requerida para el análisis». En este proceso emplean dos técnicas «next generation sequencing» –identificar los embriones portadores de la enfermedad genética de la que son portadores sus progenitores– y «karyomapping», –detectar alteraciones del número de cromosomas en los embriones, evitando la transferencia de estos embriones anormales–.
✕
Accede a tu cuenta para comentar


