
Descubrimiento
Investigadores españoles logran ver la inflamación del cerebro, in vivo, por primera vez
Este hallazgo puede cambiar el rumbo del estudio y el abordaje de las enfermedades neurodegenerativas
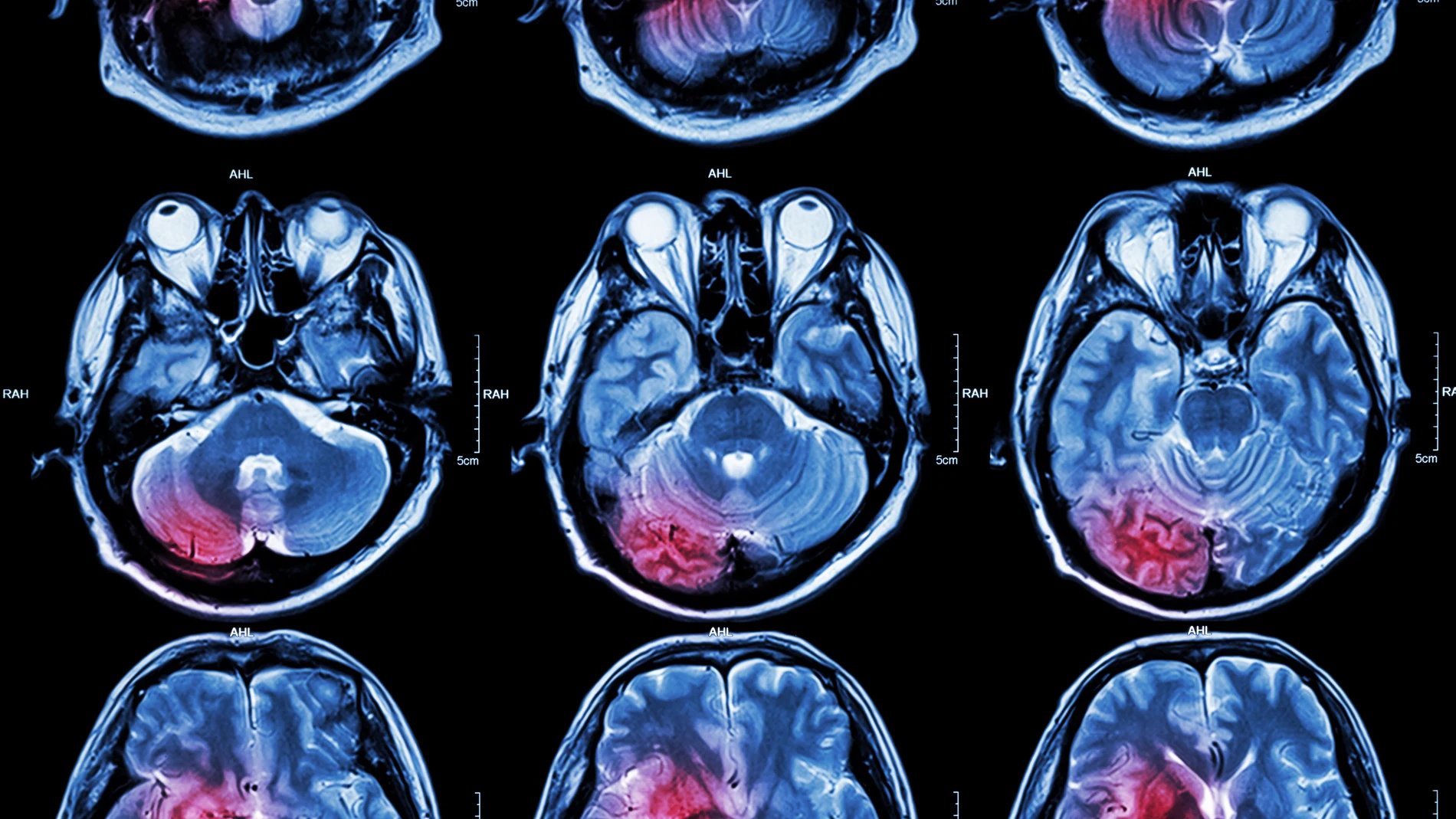
Una investigación conjunta de los laboratorios dirigidos por Silvia de Santis y Santiago Canals, del Instituto de Neurociencias UMH-CSIC, ha permitido visualizar por primera vez y con gran detalle la inflamación cerebral utilizando resonancia magnética ponderada por difusión. Esta detallada «radiografía» de la inflamación no puede obtenerse con una resonancia magnética convencional, sino que requiere secuencias de adquisición de datos y modelos matemáticos especiales. Una vez desarrollado el método, los investigadores han podido cuantificar las alteraciones en la morfología de las diferentes poblaciones de células implicadas en el proceso inflamatorio cerebral.
Una estrategia innovadora desarrollada por los investigadores ha hecho posible este importante avance, que se publica en la revista «Science Advances» y que puede ser crucial para cambiar el rumbo del estudio y tratamiento de las enfermedades neurodegenerativas.
La investigación, cuya primera autora es Raquel Garcia-Hernández, demuestra que la resonancia magnética ponderada por difusión puede detectar de forma no invasiva y diferenciada la activación de la microglía y los astrocitos, dos tipos de células del cerebro que están en la base de la neuroinflamación y su progresión.
Las enfermedades cerebrales degenerativas como alzhéimer y otras demencias, párkinson o esclerosis múltiple son un problema acuciante y difícil de abordar. La activación sostenida de dos tipos de células del cerebro, la microglía y los astrocitos conduce a una inflamación crónica en el cerebro que es una de las causas de la neurodegeneración y contribuye a su progresión.
Avance transformador
Sin embargo, hay una carencia de enfoques no invasivos capaces de caracterizar específicamente la inflamación cerebral in vivo. El estándar de oro actual es la tomografía por emisión de positrones (PET), pero es difícil de generalizar y está asociada a exposición a la radiación ionizante, por lo que su uso está limitado en poblaciones vulnerables y en estudios longitudinales, que requieren el uso de PET de manera repetida durante un periodo de años, como es el caso de las enfermedades neurodegenerativas.
Otro inconveniente del PET es su baja resolución espacial, que la hace inadecuada para obtener imágenes de estructuras pequeñas, con el inconveniente añadido de que los radiotrazadores específicos de la inflamación se expresan en múltiples tipos de células (microglía, astrocitos y endotelio), lo que impide diferenciarlas.
Frente a estos inconvenientes, la resonancia magnética ponderada por difusión tiene la capacidad única de obtener imágenes de la microestructura cerebral in vivo de forma no invasiva y con alta resolución, al capturar el movimiento aleatorio de las moléculas de agua en el parénquima cerebral para generar contraste en las imágenes de resonancia magnética.
Avance transformador
En este estudio los investigadores han desarrollado una estrategia innovadora que permite obtener imágenes de la activación de la microglía y de los astrocitos en la materia gris del cerebro mediante resonancia magnética ponderada por difusión (dw-MRI).
«Es la primera vez que se demuestra que la señal de este tipo de resonancia magnética puede detectar la activación microglial y astrocitaria, con huellas específicas para cada población de células. Esta estrategia que hemos utilizado refleja los cambios morfológicos validados post-mortem por inmunohistoquímica cuantitativa», señalan los investigadores. También han demostrado que esta técnica es sensible y específica para detectar la inflamación con y sin neurodegeneración, por lo que ambas condiciones pueden ser diferenciadas. Además, permite discriminar entre la inflamación y la desmielinización característica de la esclerosis múltiple.
Este trabajo ha logrado demostrar también el valor traslacional del enfoque utilizado en una cohorte de humanos sanos a alta resolución, «en la que realizamos un análisis de reproducibilidad. La asociación significativa con patrones de densidad de microglía conocidos en el cerebro humano apoya la utilidad del método para generar biomarcadores de glía fiables. Creemos que caracterizar, mediante esta técnica, aspectos relevantes de la microestructura tisular durante la inflamación, de forma no invasiva y longitudinal, puede tener un tremendo impacto en nuestra comprensión de la fisiopatología de muchas afecciones cerebrales, y puede transformar la práctica diagnóstica actual y las estrategias de seguimiento del tratamiento de las patologías neurodegenerativas», destaca Silvia de Santis.
✕
Accede a tu cuenta para comentar

Experiencias en el extranjero



