
Investigación
Placenta cambiante: cómo cooperan las células maternas y las fetales que no coinciden genéticamente
Investigadores de la Universidad de Medicina de Stanford han detectado que las células maternas y fetales que no coinciden genéticamente cooperan para reestructurar las arterias uterinas.
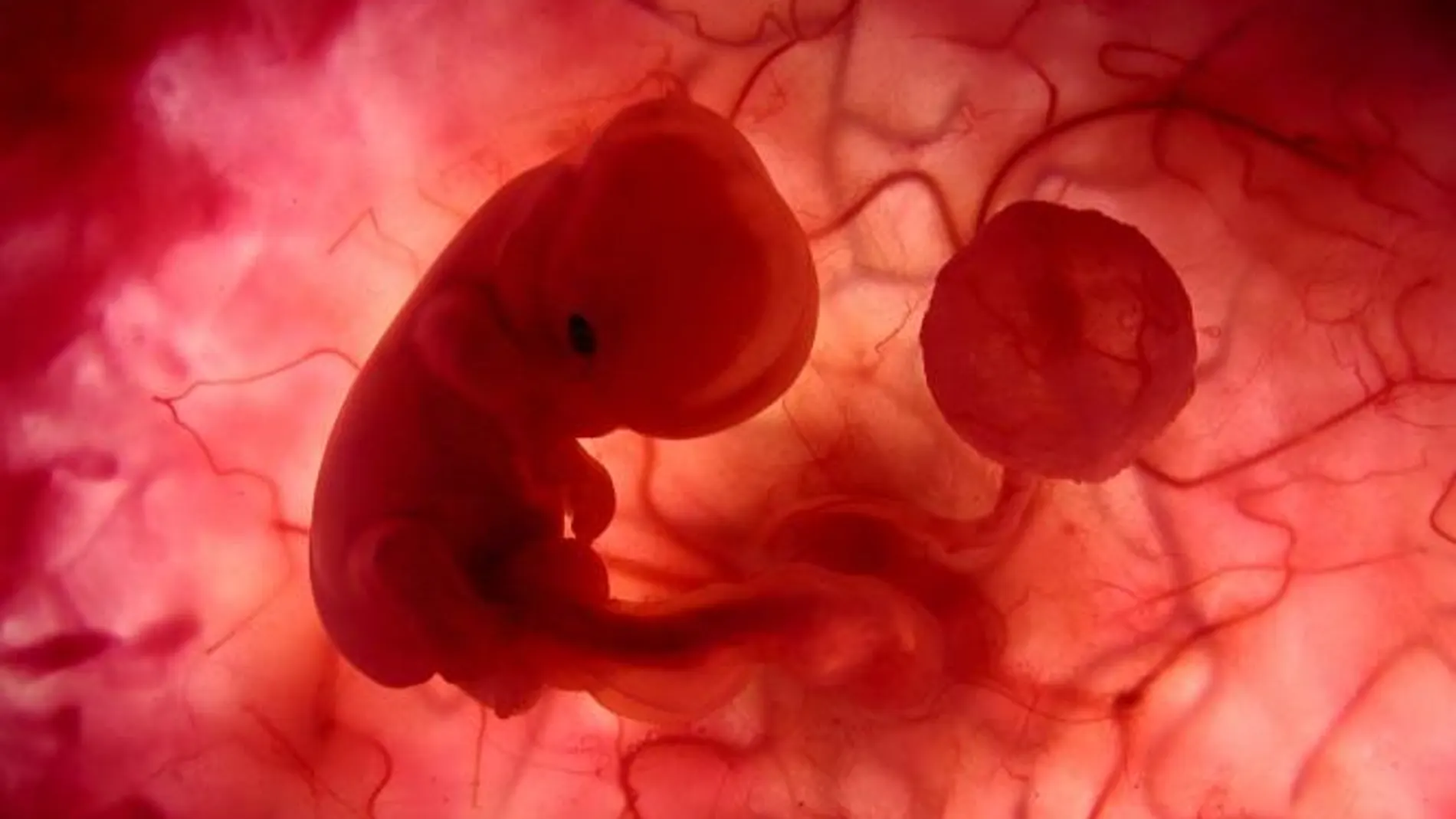
Los sistemas inmunológicos suelen atacar las células desconocidas, lo que en teoría podría suponer un problema para un embarazo en desarrollo. Pues bien, al principio del embarazo las células del lado fetal de la placenta en desarrollo invaden el endometrio uterino y trabajan con el sistema inmunitario de la madre para remodelar las arterias.
En el lado materno de la placenta, las arterias incorporan células que coinciden genéticamente con el embrión.
Investigadores de la Universidad de Medicina de Stanford han detectado, según «Nature», que las células maternas y fetales que no coinciden genéticamente cooperan para reestructurar las arterias uterinas.
Estudiar cómo se forma la placenta humana es difícil porque crece más profundamente que en otros mamíferos.
Conocer los detalles del desarrollo ayudaría a comprender qué es lo que falla en las complicaciones del embarazo, como la placenta acreta, que es aquella que es demasiado invasiva y que puede causar hemorragias en el parto al enredarse demasiado en el útero; la preeclampsia, que los investigadores creen que tiene su origen en una placenta poco invasiva, y los abortos espontáneos en los que la placenta no se establece en la pared uterina, recoge el comunicado del estudio.
El equipo de investigadores cartografió la coordinación entre unas células llamadas trofoblastos, que se originan en el lado fetal de la placenta y envían señales que coordinan la remodelación de las arterias, y el sistema inmunitario de la madre, que se adapta para acomodar estas células desconocidas a medida que se forma la placenta.
A los cinco o seis días de la fecundación, el óvulo se ha dividido suficientes veces para formar una bola de células llamada blastocisto, que tiene células internas y externas diferenciadas. Las células internas se agrupan y empiezan a formar el embrión. Las células externas, también llamadas trofoblastos, forman las estructuras de soporte, incluida la placenta.
Al final, la placenta desarrolla tres capas: vasos sanguíneos en el lado fetal que recogen oxígeno y nutrientes y eliminan desechos, vasos sanguíneos remodelados en el lado materno que aportan los nutrientes necesarios para el crecimiento del feto y un espacio abierto en el centro que se llena con la sangre de la madre que baña los vasos sanguíneos fetales para facilitar el intercambio de nutrientes y desechos.
Para llevar suficiente sangre a este espacio intermedio, sobre todo en el último trimestre del embarazo, cuando el crecimiento fetal se acelera, las arterias maternas del útero tienen que ensancharse. Los músculos de las paredes arteriales desaparecen y son sustituidos por trofoblastos para que las arterias puedan actuar como un conducto más suave de suministro de sangre.
Si las arterias no se dilatan lo suficiente durante la remodelación al principio del embarazo, la tensión arterial de la madre aumenta para compensar el bajo flujo sanguíneo, lo que, según los científicos, contribuye al desarrollo de la preeclampsia.
Para estudiar el proceso de formación de la placenta, los investigadores etiquetaron células y proteínas distintas en tejidos, con un método desarrollada por ellos (MIBI-TOF).
En muestras de tejido archivadas de 66 pacientes que se habían sometido a abortos electivos entre las semanas 6 y 20 de embarazo, los investigadores identificaron 588 arterias uterinas en espiral (llamadas así por su forma antes de la remodelación) y las clasificaron según la fase del proceso de remodelación en que se encontraban.
La técnica MIBI-TOF permitió a los investigadores rastrear hasta 37 marcadores celulares en cada imagen, proporcionando una imagen detallada de los cambios moleculares y las localizaciones celulares en cada muestra de tejido. Pudieron identificar qué tipos de células inmunitarias maternas estaban presentes en cada fase de la remodelación y dónde se encontraban exactamente los trofoblastos.
"Este ha sido el primer estudio en el que se ha cartografiado exhaustivamente cómo cambian las arterias espirales, desde las no remodeladas hasta las totalmente remodeladas", afirma Michael Angelo, patólogo de Stanford Medicine.
El equipo también se preguntó cómo llegan los trofoblastos a las paredes arteriales. Descubrieron que las arterias se remodelaban de forma sincopada y que cada una de ellas iniciaba el proceso en un momento distinto al principio del embarazo. La fase de remodelación de cada arteria se correlacionaba con el número de trofoblastos cercanos.
En el proceso también influyó el sistema inmunitario de la madre, que cambia al ritmo de la gestación. Al principio del embarazo, en torno a las seis u ocho semanas, las células inmunitarias maternas suelen ser más propensas a atacar a las células extrañas; entre las semanas 16 y 20 de gestación, se relajan y adoptan un estado más tolerante.
El objetivo del equipo es determinar cómo pueden aplicar estos hallazgos para avanzar en la atención médica del embarazo, los trasplantes de órganos (al mejorar la tolerancia) e incluso el cáncer. Además, este trabajo podría ayudar a explicar ciertos tipos de infertilidad y conducir a su tratamiento.
✕
Accede a tu cuenta para comentar




