
Anticonceptivos
Sanidad retira durante 90 días el anticonceptivo Essure
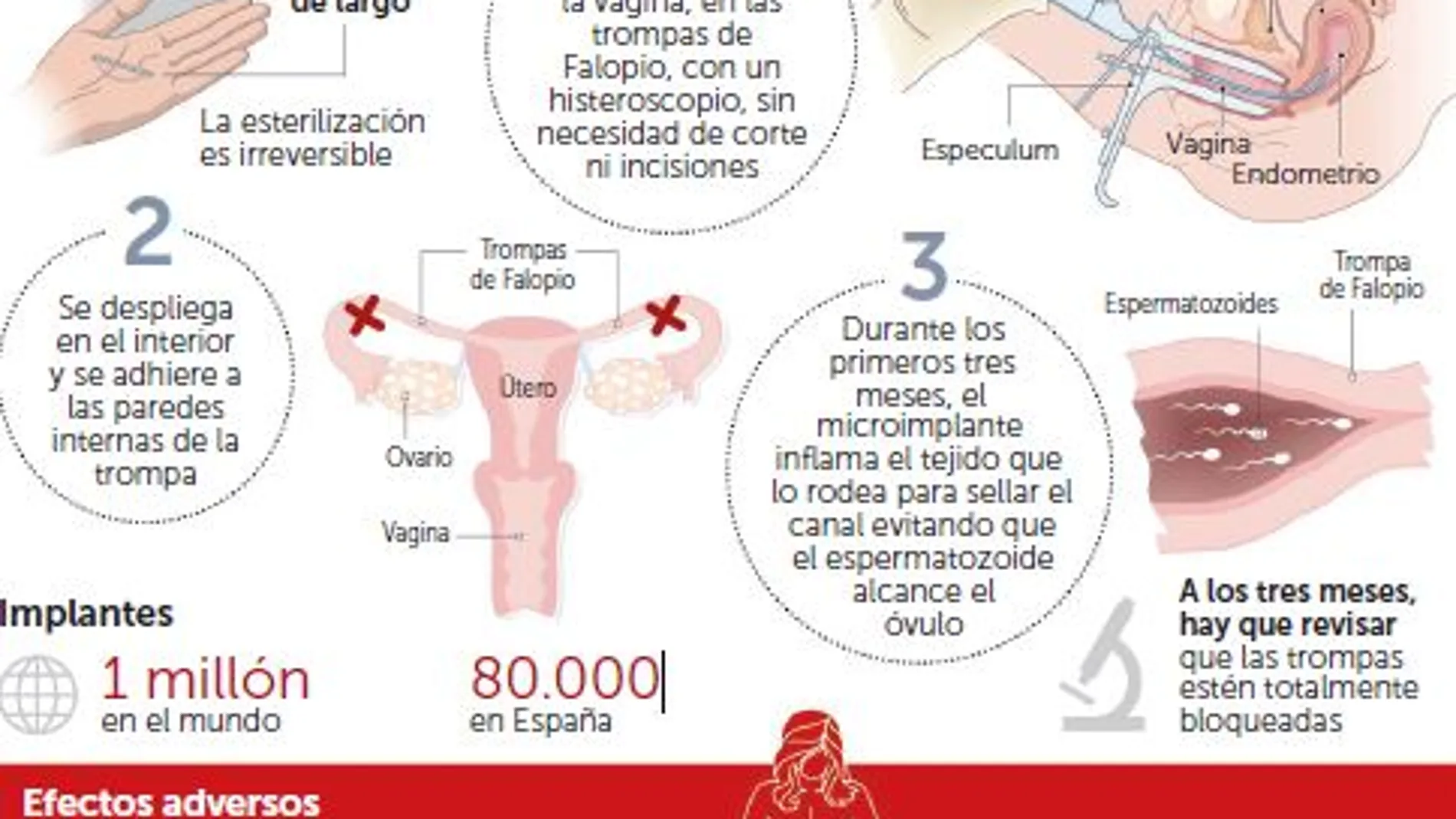
La Agencia Española del Medicamento ha tomado esta medida cautelar dado que el dispositivo «no dispone de un certificado en vigor de marcado CE». Al mismo tiempo, no aconseja ninguna medida especial a las mujeres que lo portan
La Agencia Española del Medicamento ha tomado esta medida cautelar dado que el dispositivo «no dispone de un certificado en vigor de marcado CE».
De momento, los expertos consultados por A TU SALUD apuntan a que la medida cautelar que la Agencia Española del Medicamento y Productos Sanitarios (Aemps) ha tomado con el anticonceptivo Essure –comercializado por Bayer– es unmero trámite administrativo. A principios de agosto la Aemps, dependiente del Ministerio de Sanidad, emitió una nota en la que manifestaba que la empresa que lo comercializaba debía dejar de hacerlo e instaba a los profesionales españoles a que cesaran en su uso. Lo que para muchos podría ser un nuevo capítulo de la polémica que ha generado las secuelas del este dispositivo que proporcionaba anticoncepción femenina, para los médicos supone un trámite burocrático sin trascendencia.
La agencia añade en la nota publicada que«no procede aconsejar la retirada del dispositivo ni modificar las pautas de seguimiento de las personas portadoras. Las pacientes que experimenten alguna sintomatología deben consultar con su médico –afirma y continúa–. Las mujeres que estuvieran a la espera de una implantación por este método de esterilización definitivo –destaca la nota de la Aemps–, deberán valorar con su médico los métodos de contracepción disponibles más adecuados y sus eventuales efectos indeseables». La suspensión del certificado tiene efectos desde el 3 de agosto de 2017 y por un periodo de 90 días hasta el 2 de noviembre de 2017.
Ante esta situación, Miguel Ángel Rodríguez Zambrano, jefe de Servicio del Hospital Universitario HM Puerta del Sur de Madrid, explica con detalle que «la retirada del producto de manera cautelar supone un retraso en la recertificación que debía haber sido aprobada en 3 de Agosto por una comisión irlandesa, y que es necesaria para seguir siendo comercializado en el espacio de la Unión Europea. Al no haber podido la comisión analizar los cambios que se solicitaron en la ficha técnica y en otras indicaciones a la casa comercializadora, se ha dado una prorroga de tres meses para analizarlo, y si lo estiman conveniente recertificarlo y proceder a la autorización de su uso. En principio parece nada más que una situación transitoria».
La farmacéutica explica en un comunicado el proceso que ha llevado a esta situación después de que la National Standards Authority of Ireland (NSAI) suspendiera temporalmente el marcado CE necesario para la comercialización de Essure en la Unión Europea.
La NSAI decidió no renovar el certificado, según Bayer, debido a que «no se terminaron de cerrar las cuestiones asociadas al proceso de recertificación antes de la fecha del vencimiento del marcado vigente, que expiraba el pasado 3 de agosto, hasta que no quedaran resueltas estas cuestiones pendientes». Y el resultado de esta decisión –recuerda la empresa– es el cese en la comercialización de Essure en aquellos mercados donde el producto se distribuye con el marcado CE, entre los que se encuentra España.
Tranquilidad
Sin embargo, tanto los médicos como la Aemps insisten en un mensaje de tranquilidad para las pacientes que lo portan, así como aquellas que hubieran decidido optar por él, aunque de momento no puedan hacerlo. «En consulta hemos tenido muchas pacientes que han elegido este método de anticoncepción femenina pese a la polémica. Nosotros les informamos de que existía un asociación en España que denunciaba sus secuelas y les explicamos las mismas», manifiesta Mercedes Andeyro, jefa del Servicio de Ginecología y Obstetricia del Hospital General de Villalba en Madrid.
Por su parte, Zambrano opina que «las pacientes que lo llevan pueden estar tranquilas. No hay ninguna indicación de retirarlo a aquellas pacientes que lo portan ni notificaciones de alteraciones en su seguridad. Se siguen manteniendo los escasos efectos secundarios que están descritos y que solamente ocurren en un pequeño número de pacientes. No deben preocuparse en absoluto y debe seguir sus revisiones ordinarias».
Sin embargo, mientras Andeyro cree que este trámite «va a terminar por suponer una retirada del único método anticonceptivo definitivo ambulatorio y para muchos es un retraso», para Zambrano tan sólo «es algo transitorio, con el fin de completar una serie de requerimientos en su ficha técnica que se ha solicitado. En EE UU sigue estando operativo y no se espera su retirada».
✕
Accede a tu cuenta para comentar


