
Ciencia
Un tipo de hielo imposible de encontrar en la Tierra
Descubren la estructura del hielo tipo XIX, un cristal imposible de encontrar en este planeta

En el colegio nos enseñan que el agua se enfría hasta formar hielo y se calienta hasta formar vapor. Pero en el caso del hielo, esta afirmación es inexacta. El agua puede congelarse de diferentes maneras y formar varios tipos de hielo. Hasta la fecha hemos encontrado diecinueve tipos de hielo diferentes. El último de ellos, el hielo XIX, ha sido recientemente publicado por un laboratorio austriaco en la revista científica Nature Communications. La mayoría de estos tipos alternativos de hielo no existen en nuestro planeta, pero son importantes en la exploración espacial y la geología.
Versiones alternativas
Desde un punto de vista químico, la molécula de agua ocupa un lugar espacial. Está formada por un átomo de oxigeno central, unido a dos átomos de hidrógeno a los lados. Pero su peculiaridad está en su ángulo. Los electrones del oxígeno empujan a las moléculas de hidrógeno haciendo que, en vez de formar una molécula con los tres átomos alineados, los hidrógenos guarden un ángulo de 104 grados con el oxígeno. Así, estas moléculas pueden formar diferentes estructuras tridimensionales como las piezas de un mecano.
Este ángulo y la distribución de cargas del hidrógeno y del oxígeno permiten que las moléculas de agua puedan interaccionar entre ellas a través de un tipo de enlace llamado puente de hidrógeno. Este enlace es mucho más débil que un enlace químico, y les permite acercarse y alejarse con facilidad.
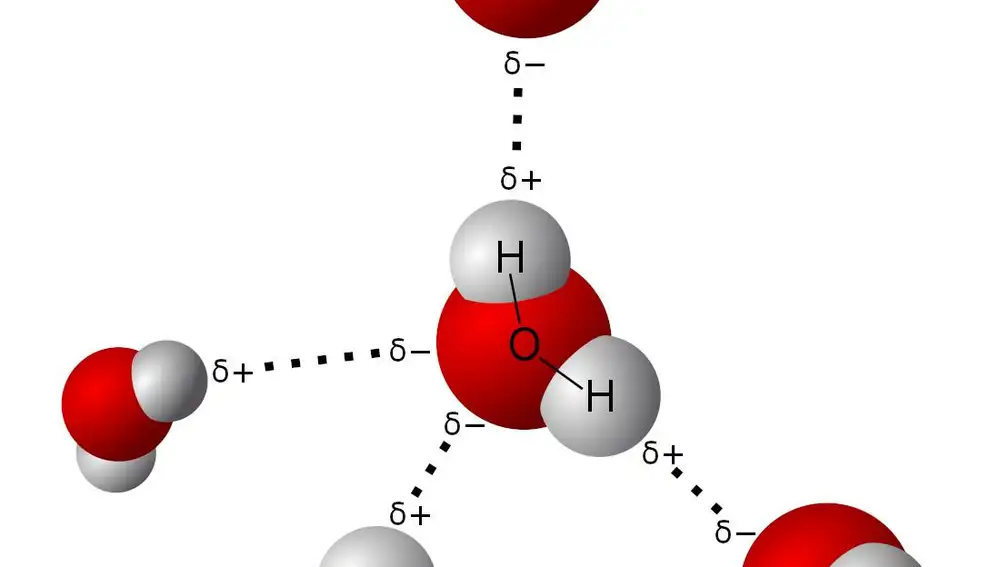
Los puentes de hidrógeno afectan a las propiedades químicas del agua. A temperatura ambiente el agua es líquida por culpa de estas interacciones, que hacen que se condense y no forme un gas. Si la temperatura baja, las moléculas empiezan a moverse más lentamente y tienen la oportunidad de acercarse para formar hielo.
Así, el hielo es un cristal formado por moléculas de agua ordenadas formando una red. Son cristales rígidos, pero como los puentes de hidrógeno acercan menos las moléculas entre sí, el hielo es sorprendentemente ligero, siendo capaz de flotar sobre el agua líquida.
Hasta aquí lo que nos enseñan en el colegio, pero hay más. El hielo puede formar diferentes tipos de cristales, con las moléculas de agua ordenadas en diferentes distribuciones. El hielo común que podemos encontrar en nuestro congelador se distingue porque los átomos de oxígeno se distribuyen formando hexágonos, y se conoce como Hielo tipo I. A partir de ahí, tenemos otros diecinueve tipos de redes diferentes, nombradas como Hielo II, Hielo III, etcétera.
Estos cristales de hielo son difíciles de diferenciar a simple vista, pero tienen propiedades químicas diferentes. No se derriten a la misma temperatura, pueden conducir peor o mejor la electricidad, y tienen durezas diferentes. Por eso, muchos químicos los estudian como materiales independientes al hielo común.
La diferencia entre estos hielos es la receta para formarlos. No es lo mismo enfriar agua de golpe a menos 200 grados centígrados que hacerlo de manera gradual. Y tampoco es lo mismo tener el agua a altas presiones (donde las moléculas están más pegadas) que a bajas. La temperatura y presión definen cómo se van a acercan las moléculas de agua al formar el hielo, y favorecerán que se formen diferentes tipos de cristales.
Una estructura difícil de conseguir
El último descubrimiento ha sido la estructura del hielo XIX, el último en la lista de hielos conocidos. Hace unos años, un equipo de investigación austriaco, dirigido por Thomas Loerting, había logrado encontrar una nueva receta de hielo. Con una presión muy alta y un enfriamiento lento, el agua se agrupaba rápidamente en una nueva red de hielo que bautizaron como hielo XIX. El problema es que, aunque sabían que habían formado un nuevo tipo de hielo, no conocían su estructura.
Para conocer la estructura de un cristal de hielo, se suele usar una técnica conocida como difracción de neutrones. Para ello, se modifican moléculas de agua, sustituyendo sus átomos habituales de hidrógeno por átomos de deuterio, una forma del hidrógeno que incluye un neutrón más en su núcleo. Al agua con estas moléculas se la conoce como agua pesada, y refleja los rayos X de manera que nos permite conocer la distribución espacial del cristal que se forma.
Esta estrategia había funcionado para conocer todas las redes de hielo descubiertas hasta la fecha, pero con el hielo XIX era imposible. El agua pesada necesita algo más de tiempo para formar hielo, ya que el deuterio no interacciona tan bien como el hidrógeno normal. Para otros tipos de hielo esto se soluciona esperando un poco más, pero el hielo XIX se genera cuando las moléculas de agua se unen a gran velocidad por culpa de las altas presiones, y esto es imposible con el agua pesada. Con agua pesada no tienen hielo XIX, y sin agua pesada, no tienen manera de ver la estructura.

La solución vino de un estudiante del laboratorio, Tobias Gasser, que decidió probar algo sencillo: mezclar agua normal y agua pesada. En la proporción correcta, las moléculas de agua normal formaban el hielo XIX y las pesadas se dejaban llevar para formar la estructura correcta. Tras varios intentos en paralelo con otro laboratorio japonés, ambos laboratorios lograron encontrar y publicar la estructura del hielo XIX.
Para su sorpresa, en la red cristalina del hielo XIX, los átomos de oxígeno se distribuyen exactamente igual que otro tipo de hielo ya conocido, el hielo tipo VI. La diferencia está en los átomos de hidrógeno, que si tienen una colocación diferente dentro del cristal y que explica las diferencias de conductividad eléctrica que habían encontrado.
Es muy probable que no veamos ningún tipo de hielo aparte del hielo I. Estos cristales de hielo alternativos se forman bajo condiciones muy extremas de temperatura y presión, que no son las que habitualmente se dan en el planeta Tierra. La única excepción es la de los hielos tipo VI y VII, que se han encontrado como incrustaciones dentro de diamantes. Las altas presiones que dan lugar al diamante pueden presionar restos de agua internos formando burbujas de estos tipos de hielo alternativo.
Pero, aunque estos hielos no sean frecuentes en nuestro planeta, sí que pueden surgir en el espacio. Algunos cuerpos celestes incluyen capas de hielo alternativo formadas en condiciones extremas de temperatura y presión. Por ejemplo, el satélite Ganímedes de Júpiter incluye varias capas de hielo en su superficie, cada una de ellas formada por un tipo de hielo diferente.
Conocer y formar cristales de hielo alternativo en el laboratorio nos ayuda a deducir como es la superficie de otros cuerpos celestes. Puede que en un futuro, conocer la rigidez del hielo tipo III en un pequeño cristal artificial sea la clave para poder aterrizar un dron en una luna lejana o formar una base espacial.
QUE NO TE LA CUELEN:
- Los copos de nieve se forman con hielo tipo I y eso explica su forma. Esta red de hielo tiene una distribución de oxígenos formando hexágonos, y cuando se acumulan los cristales en motas de polvo, acaban formando figuras geométricas de seis lados, siguiendo la simetría del hexágono.
REFERENCIAS:
✕
Accede a tu cuenta para comentar


