
Salud
Alerta por riesgo para la salud con los respiradores de Philips
Los problemas de salud asociados a estos dispositivos incluyen irritación de la piel, los ojos y las vías respiratorias, inflamación, dolor de cabeza o asma, así como efectos tóxicos y cancerígenos
Emplear respiradores y máquinas para la apnea del sueño (CPAP y BiPAP) de Philips puede entrañar riesgos para la salud. Tal y como recoge el aviso emitido el pasado martes por la Agencia Española del Medicamento y Productos Sanitarios (Aemps), «estos problemas pueden provocar lesiones graves que podrían ser potencialmente mortales, causar disfunciones permanentes y/o requerir intervención médica para impedir la disfunción permanente».
El motivo de este aviso han sido dos problemas relacionados con la espuma de reducción de ruido de poliuretano a base de poliéster (PE-PUR: polyester-based polyurethane) que contienen, detectados por la propia compañía, ya que se ha visto que ésta puede degradarse hasta producir partículas que pueden entrar en el flujo de aire del dispositivo y ser inhaladas o ingeridas por el usuario.
La degradación de esta espuma puede agravarse mediante el uso de métodos de limpieza del dispositivo no aprobados, como el ozono. También se ha visto que otros factores como el paso del tiempo, los entornos con elevada temperatura y/o mucha humedad también podrían contribuir a la degradación de este foam. La emisión de sustancias podría ocurrir durante el funcionamiento inicial y podría continuar durante toda la vida útil del aparato, que se estima en cinco años.
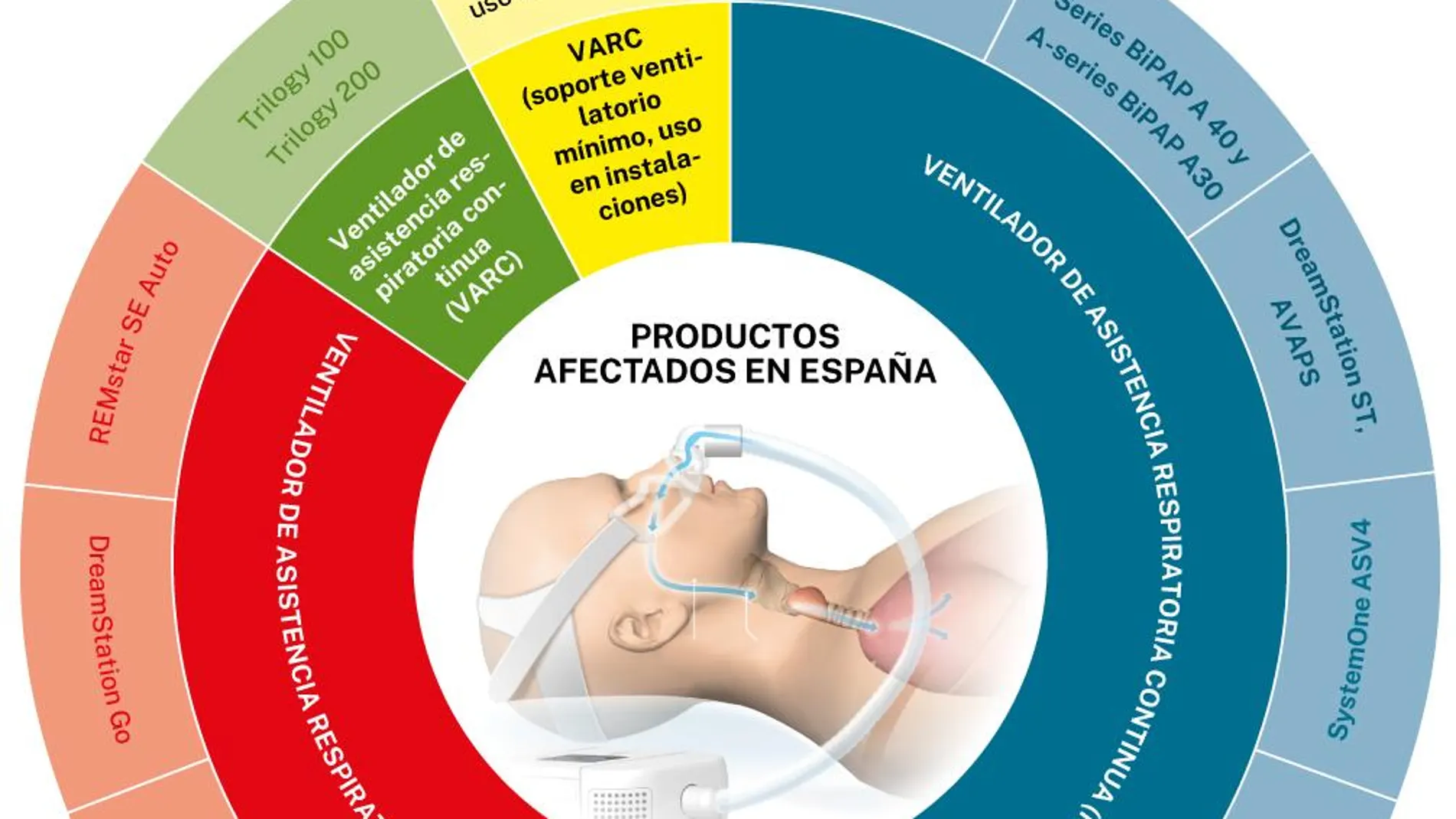
La mayoría de los dispositivos afectados pertenecen a la familia de productos DreamStation de primera generación (ver gráfico) y que en Estados Unidos Philips se ha visto obligada a retirarlos tras poner en conocimiento de la Agencia Americana del Medicamento (FDA) los problemas. En España se cree que puede haber en torno a unos 150.000 equipos afectados.
La empresa ha recibido algunas quejas sobre la presencia de residuos negros en el circuito del flujo de aire (desde la salida del dispositivo al humidificador, los tubos y la mascarilla), y también se le ha informado de casos de cefalea, irritación de las vías respiratorias altas, tos, presión torácica e infección sinusal.
Como explica la doctora Olga Mediano, coordinadora del Área de trastornos del sueño y ventilación mecánica de la Sociedad Española de Neumología y Cirugía Torácica (Separ), «los problemas de salud asociados a la exposición de las partículas incluyen: irritación (de la piel, los ojos y las vías respiratorias), respuesta inflamatoria, cefalea, asma, sucesos adversos en otros órganos (como en hígado y riñones), así como efectos tóxicos y cancerígenos». Además, los riesgos de la exposición química por la emisión de gases son cefaleas/mareos, irritación de los ojos, nariz, vías respiratorias y piel, hipersensibilidad, náuseas/vómitos, y efectos tóxicos y cancerígenos.
Mientras en Estados Unidos se ha emitido una notificación de retirada del mercado de los productos afectados, para el resto del mundo, de momento y a la espera de que se pronuncie la Agencia Europea del Medicamento (EMA), tan solo ha sido una de seguridad. Así, en España, a aquellas personas que sean usuarias de uno de los ventiladores de asistencia respiratoria afectados la Aemps les recomienda no interrumpir el tratamiento y, en caso de experimentar alguno de los síntomas descritos en la nota informativa contacte con su médico.
Establecer prioridades
Esto es así porque, «no todos los equipos se podrán cambiar a la vez, por eso habrá que establecer prioridades para proceder su sustitución ya que en muchos casos son equipos de soporte vital. Primero habría que empezar con las personas más necesitadas y también aquellos equipos más antiguos», explica Mediano.
Esclerosis lateral amiotrófica (ELA), distrofias musculares, enfermedades de la caja torácica o síndrome de hipoventilación obesidad son solo algunas de las patologías en las este tipo de equipos resultan imprescindibles, además de las personas aquejadas de apnea obstructiva del sueño.
La Aemps también recomienda contactar con su empresa de terapia domiciliaria para que le haga entrega de la nota de aviso para pacientes y consulte las alternativas para el reemplazo de su dispositivo así como confirmar con la empresa de terapia domiciliaria que presta el servicio si el equipo ha sido registrado en el sitio web de Philips para que puedan implementar la solución permanente. Esta pasaría por «cambiar la pieza de foam por otra de silicona, no haría falta cambiar todo el aparato», señala Mediano.
Philips reconoce que es posible que no existan opciones de respirador alternativo o que estén muy limitadas para los pacientes que requieren un ventilador para la terapia de soporte vital o en los casos en que la interrupción de la terapia es inaceptable. En estas situaciones, y a discreción del equipo clínico a cargo del tratamiento, el beneficio del uso continuado de estos dispositivos de ventilación puede superar los riesgos identificados en la notificación de seguridad del mercado.
✕
Accede a tu cuenta para comentar



