
Alerta
La Agencia del Medicamento advierte del riesgo para la salud de algunos aparatos de soporte respiratorio de Philips
La espuma empleada en estos dispositivos, como los de la apnea del sueño, puede degradarse y ser inhalada o ingerida por el usuario provocando lesiones graves potencialmente mortales
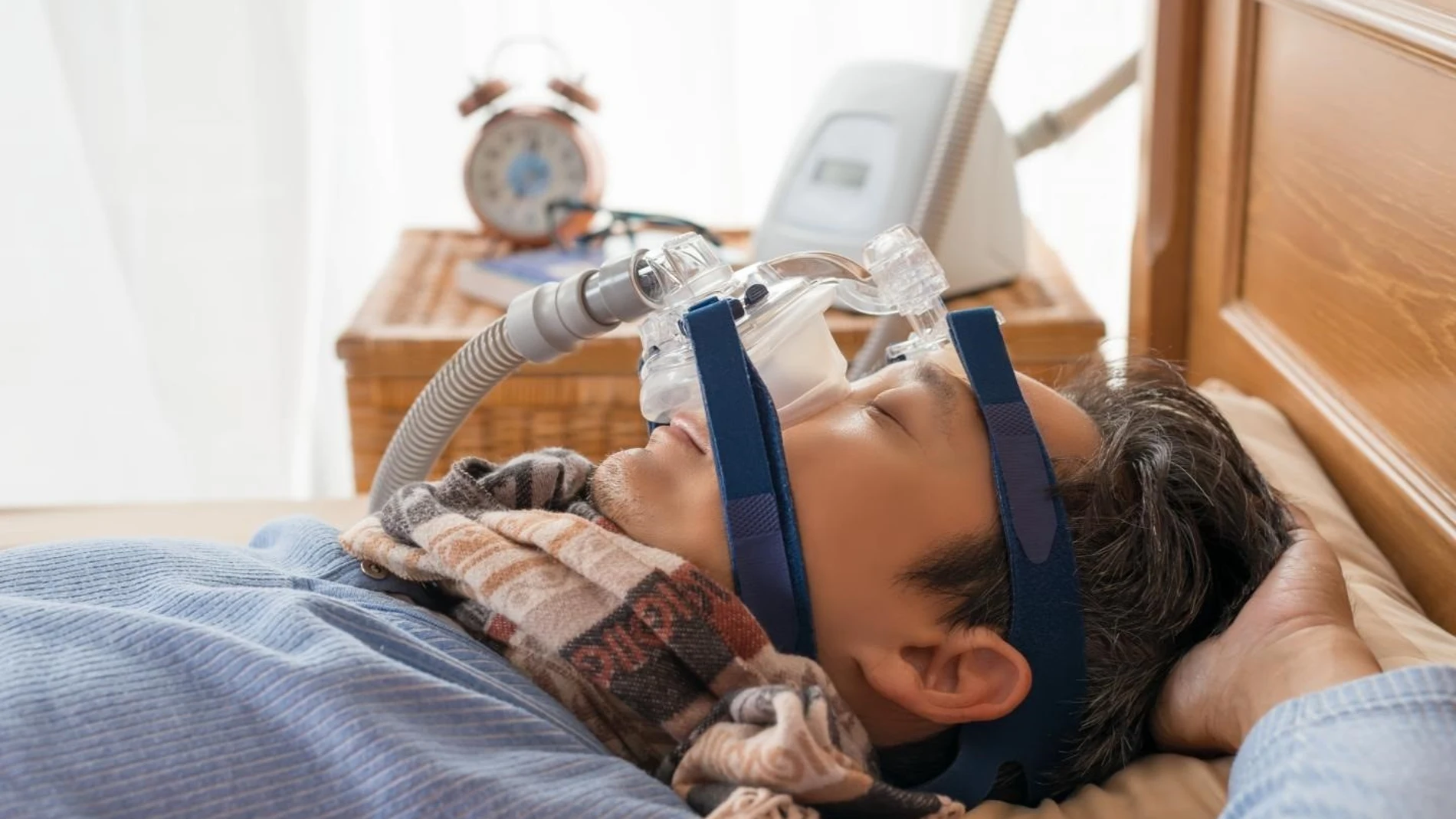
La Agencia Española de Medicamentos y Productos Sanitarios (Aemps) ha sido informada por parte de la empresa Philips Ibérica de la retirada del mercado de determinados ventiladores de asistencia respiratoria continua e intermitente, fabricados por Philips Respironics, EE UU. Esta retirada se debe a la posibilidad de degradación de la espuma de reducción de ruido que se utiliza en estos ventiladores de asistencia respiratoria.
De acuerdo con la información facilitada por la empresa se han detectado dos problemas relacionados con la espuma de reducción de ruido de poliuretano a base de poliéster (PE-PUR: polyester-based polyurethane) ya que se ha visto que esta puede degradarse hasta producir partículas que pueden entrar en el flujo de aire del dispositivo y ser inhaladas o ingeridas por el usuario.
La espuma de PE-PUR puede emitir ciertas sustancias. La degradación de la espuma puede agravarse mediante el uso de métodos de limpieza del dispositivo no aprobados, como el ozono. La emisión de sustancias podría ocurrir durante el funcionamiento inicial y, posiblemente, podría continuar durante toda la vida útil del dispositivo. Estos problemas pueden provocar lesiones graves que podrían ser potencialmente mortales, causar disfunciones permanentes y/o requerir intervención médica para impedir la disfunción permanente.
Síntomas
La empresa ha recibido algunas quejas sobre la presencia de partículas/residuos negros en el circuito del flujo de aire (desde la salida del dispositivo al humidificador, los tubos y la mascarilla), y también se le ha informado de casos de cefalea, irritación de las vías respiratorias altas, tos, presión torácica e infección sinusal. Los riesgos de la exposición a partículas incluyen: irritación (de la piel, los ojos y las vías respiratorias), respuesta inflamatoria, cefalea, asma, sucesos adversos en otros órganos (como en hígado y riñones), y efectos tóxicos y cancerígenos. Los riesgos de la exposición química por la emisión de gases incluyen: cefaleas/mareos, irritación de los ojos, nariz, vías respiratorias y piel, hipersensibilidad, náuseas/vómitos, y efectos tóxicos y cancerígenos.
El fabricante ha enviado notas de aviso para distribuidores/empresas de terapia domiciliaria, junto con una nota dirigida a usuarios y pacientes domiciliarios para informar de los problemas identificados y en la que se incluyen las acciones a seguir y ha elaborado un documento con preguntas más frecuentes que se pueden encontrar en la página web del fabricante Philips.
¿Qué hacer si se está usando uno?
La Aemps ha contactado con la Sociedad Española de Neumología y Cirugía Torácica (Separ) y con las empresas de terapia respiratoria domiciliaria para valorar la situación y la posibilidad de sustitución de equipos y está realizando un continuo seguimiento de las actuaciones de la empresa.
Si usted es usuario de uno de los ventiladores de asistencia respiratoria indicados en el apartado de productos afectados la Aemps recomienda no interrumpir el tratamiento y, en caso de experimentar alguno de los síntomas descritos en la nota informativa contacte con su médico. También contactar con su empresa de terapia domiciliaria para que le haga entrega de la nota de aviso para pacientes y consulte las alternativas para el reemplazo de su dispositivo así como confirmar con su empresa de terapia domiciliaria si su equipo ha sido registrado en el sitio web de Philips para que posteriormente puedan implementar la solución permanente.
✕
Accede a tu cuenta para comentar




