Hallazgo español
Visualizan cómo actúa una proteína clave en el cáncer y el alzhéimer
Investigadores españoles ven, con detalle atómico, proteínas de la familia HAT, lo que facilitará el diseño de nuevos medicamentos contra enfermedades comunes
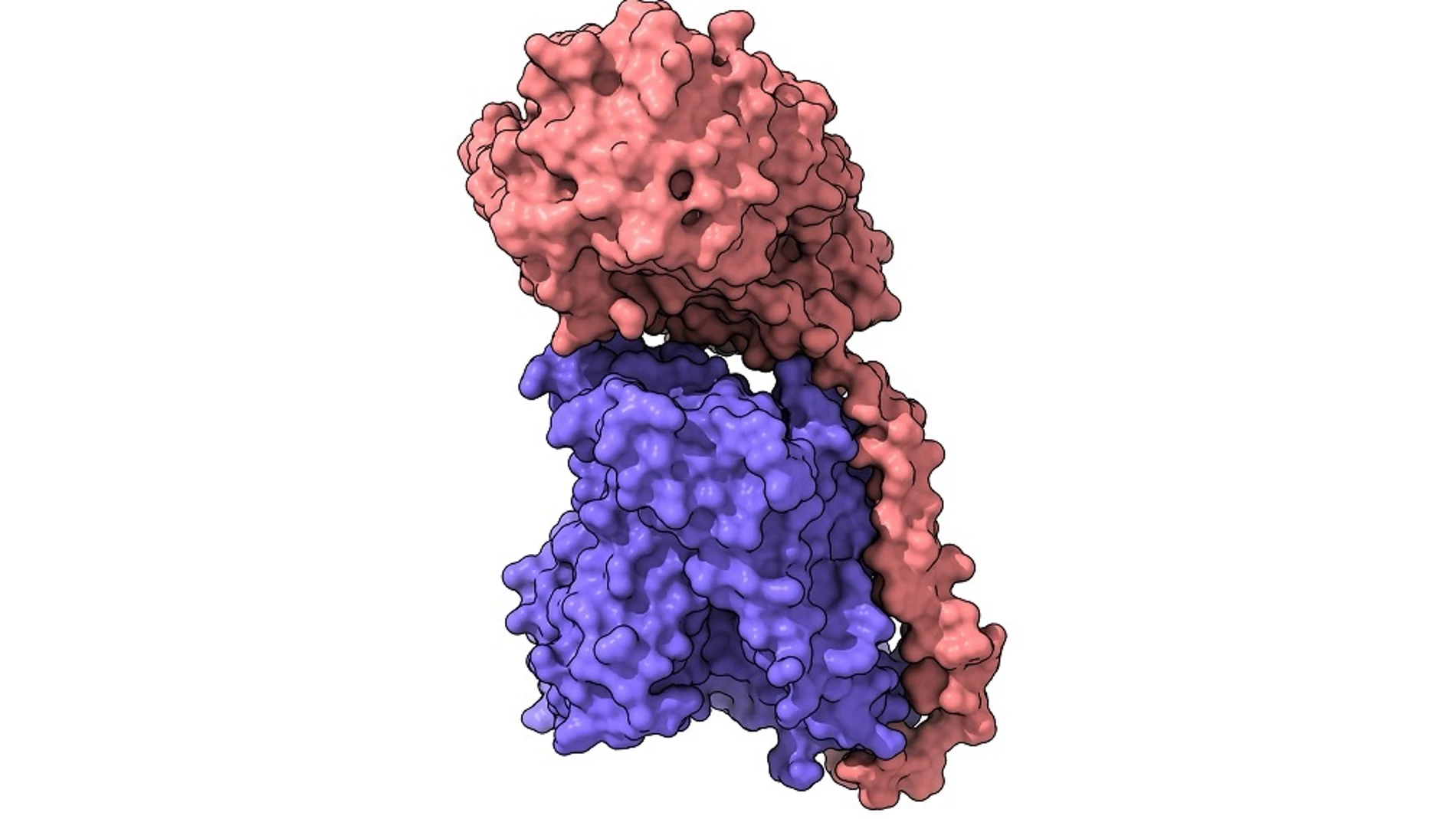
Ver para entender. Esta es la cuestión que marca un nuevo hito en la investigación médica y tiene sello español, ya que investigadores del Centro Nacional de Investigaciones Oncológicas (CNIO) y del Instituto de Investigación Biomédica (IRB Barcelona) han «puesto cara» a unas proteínas esenciales para la vida celular, las de la familia HAT, implicadas en el cáncer o el alzhéimer, ya que sirven de compuertas para la entrada y salida de aminoácidos en las células, tal y como se explica en un estudio publicado en la revista científica «Proceedings of the National Academy of Sciences».
En concreto, gracias a las últimas tecnologías de alta resolución estructural como la criomicroscopía electrónica, los investigadores han sido capaces de visualizar con detalle atómico la estructura de uno de los miembros de esta familia de proteínas y, combinado con modelado computacional y el diseño de mutantes de la proteína, entender así su funcionamiento, lo que supone un gran avance para la comunidad científica. Con esta información, el gran reto de los investigadores ahora es encontrar nuevas terapias y herramientas diagnósticas para patologías en las que están implicadas los transportadores de la familia HAT, con especial interés en aquellas enfermedades que representan graves problemas de salud pública como el cáncer o las enfermedades neurodegenerativas como el alzhéimer.
Cómo funciona
Los aminoácidos, los ladrillos básicos que permiten la vida, entran y salen de las células para que éstas puedan crecer, dividirse y desarrollar sus funciones fisiológicas. Esta entrada y salida de las células sucede gracias a las compuertas conformadas por, entre otras, las proteínas de la familia HAT, que se encuentran embebidas en las membranas de las células. A pesar de que las proteínas HAT son prácticamente idénticas en su estructura, unas transportan unos aminoácidos y no otros, lo que les confiere funciones completamente distintas. Con la finalidad de entender esta especificidad en la función, los científicos se pusieron como objetivo estudiar la estructura tridimensional de esta importante familia de proteínas. «Las técnicas más tradicionales para la determinación de la estructura de proteínas como las que utilizan rayos X han tenido un éxito limitado con proteínas que están embebidas en las membranas biológicas, por lo que muchas preguntas han quedado sin resolver», asegura Óscar Llorca, jefe del Grupo de Complejos Macromoleculares en la Respuesta a Daños en el DNA del CNIO, director del Programa de Biología Estructural del Centro y coautor del trabajo.
«La combinación de la resolución de la estructura por crio-microscopía electrónica con cálculos de dinámica molecular y estudios funcionales, supone una plataforma experimental con mucho potencial que permite desentrañar el funcionamiento de transportadores de aminoácidos. En este caso, hemos aplicado esta tecnología para la identificación de los mecanismos moleculares que hace que estas proteínas transporten unos aminoácidos y no otros», explica Manuel Palacín, jefe del laboratorio de Transportadores de Aminoácidos y Enfermedad del IRB Barcelona, jefe de grupo en el CIBER de Enfermedades Raras, y Catedrático de la Universidad de Barcelona.
Nuevos medicamentos
Gracias a las técnicas de crio-microscopía electrónica, campo en el que Llorca es un experto a nivel mundial, la visualización de la estructura molecular de proteínas ha dado un paso de gigante, ya que contribuye a acelerar el desarrollo de nuevos compuestos y fármacos de interés en la lucha contra el cáncer y otras enfermedades.
En este trabajo los investigadores han sido capaces de visualizar con resolución atómica, mediante el uso de crio-microscopía electrónica, la estructura de un miembro de la familia HAT -la proteína*LAT2/CD98hc-, y determinar el bolsillo donde se unen los aminoácidos que transportan, así como el detalle del mecanismo por el que sucede este reconocimiento. Así, el trabajo demuestra cómo las sustituciones de unos residuos por otros en estas posiciones en los distintos miembros de la familia son responsables del cambio en la especificidad de reconocimiento y transporte de unos aminoácidos y no otros. Los resultados de esta investigación permitirán dirigir ahora los esfuerzos a conseguir nuevos fármacos que actúen específicamente sobre regiones concretas de estas proteínas, y controlar las enfermedades en las que intervienen como el cáncer o el alzhéimer.
✕
Accede a tu cuenta para comentar