
Industria farmacéutica
Exponen las medidas que mejoran el acceso de los pacientes a los nuevos medicamentos
El tiempo medio que transcurre desde que un nuevo medicamento recibe la autorización en Europa hasta que está disponible en España es de 17 meses de demora, muy por detrás de vecinos como como Alemania, Francia, Italia y Reino Unido
Aunque España puede presumir de tener un nivel de investigación médica y farmacéutica de primer nivel, valorada en todo el mundo, los expertos denuncian que esa innovación tarda mucho más de lo que debería en llegar a los pacientes, lo que pone en riesgo su salud y merma su calidad de vida. La llegada de un medicamento innovador es una nueva esperanza para las personas que padecen una enfermedad y no disponen de un tratamiento todavía, y también para quienes, aun teniendo alguna opción terapéutica, pueden ver mejoradas sus expectativas de curación o de aumento de calidad de vida.
España tiene un acuciante problema de acceso a los medicamentos innovadores, que requiere una solución urgente, porque se están poniendo en riesgo la salud y el bienestar de los pacientes y se está incurriendo en costes sanitarios y no sanitarios que podrían ahorrarse gracias a los nuevos medicamentos.
Éstas son las bases de un nuevo documento de Farmaindustria que recoge las propuestas presentadas a la Administración para revertir el deterioro en los indicadores de acceso a la innovación. Este informe, bajo el título El acceso a los medicamentos en España: diagnóstico y recomendaciones, describe la situación actual, presenta un análisis de las causas y reúne una serie de medidas para atajar los principales problemas identificados.
Como viene informando la Asociación, entre 2017-2020 sólo estaban disponibles en el Sistema Nacional de Salud (SNS) 85 de los 160 fármacos aprobados en la Unión Europea, es decir, el 53%. Y el tiempo medio que transcurre desde que un nuevo medicamento recibe la autorización en Europa hasta que está disponible para su uso en España es de 517 días, más de 17 meses de demora, según el informe anual W.A.I.T. Indicator, elaborado por la consultora Iqvia.
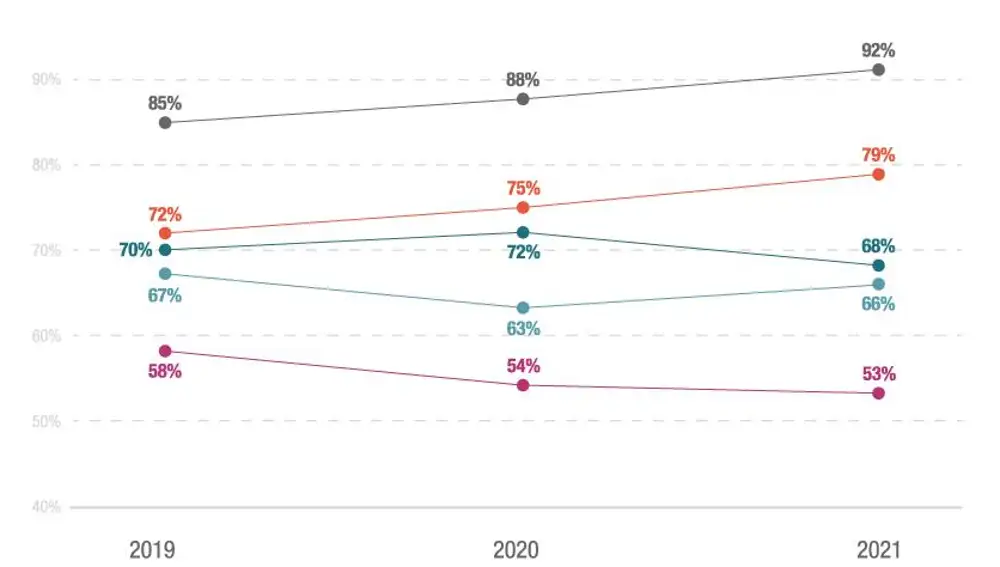
El retraso en la aprobación y la disponibilidad en España se refleja también en áreas de especial gravedad para los pacientes como la Oncología y las enfermedades raras. En ellas se han concentrado en los últimos meses las demandas de solución por parte de profesionales sanitarios y organizaciones de pacientes, y precisamente Farmaindustria, con el fin de mejorar su disponibilidad, ha hecho propuestas específicas al Ministerio de Sanidad.
“El empeoramiento del acceso a los medicamentos innovadores en España en los últimos años está dañando seriamente la calidad, efectividad, cohesión y equidad en el SNS. El principal perjuicio es para los pacientes, que no pueden acceder a los tratamientos de mayor eficacia o lo hacen con un gran retraso o en condiciones restringidas -explica Juan Yermo, director general de Farmaindustria-. Pero hay un segundo impacto, también importante, para la investigación biomédica en nuestro país, ya que las compañías farmacéuticas pueden perder su interés en invertir en el país si no ven salida a sus medicamentos innovadores”.
Reformas factibles para metas alcanzables
Esta segunda consecuencia puede impactar principalmente en los ensayos clínicos, área en la que España es un referente mundial. “El empeoramiento del acceso en el país afecta, por lo tanto, a la contribución del sector al crecimiento económico”, subraya el documento.
En este contexto, para tratar de acortar estos tiempos y equiparar las oportunidades de los pacientes españoles con las de sus vecinos europeos, “Farmaindustria viene proponiendo una serie de mejoras en el procedimiento de evaluación y fijación de precios y financiación pública de medicamentos en nuestro país. El objetivo es establecer un modelo ágil, predecible y eficiente, de manera que ayude a solucionar el problema actual”, señala Yermo.
La meta es alcanzable, pero requiere una reforma en profundidad del sistema de precio y financiación, una revisión de la función, plazos y estructura de los informes de posicionamiento terapéutico (IPT) que acompañan a los nuevos medicamentos, y mecanismos de acceso temprano en los fármacos que aporten mayor beneficio clínico a los pacientes.
En concreto, las compañías farmacéuticas proponen dotar de mayor predictibilidad, claridad y objetividad a los procedimientos y decisiones de precio y financiación de medicamentos innovadores. Las reformas necesarias en estos procedimientos deberían permitir que se cumpla el plazo establecido en la legislación para la decisión sobre financiación (180 días, frente a los 517 días de media actuales) y lograr tasas de financiación de nuevos medicamentos autorizados más cercanas a las de los países europeos de referencia.
Hacen falta también -recoge el documento- reformas en el Sistema de Precios de Referencia (SPR) para reconocer la innovación incremental, que tiene probados beneficios terapéuticos y de adherencia. Esto requiere excluir de este sistema las innovaciones incrementales que cuenten con protección de patente, alineando la regulación con los países del entorno, así como evitar que una reforma del SPR cambie el criterio de conformación de conjuntos de principio activo a indicaciones terapéuticas (ATC4).
Escuchar más a médicos y pacientes
Asimismo, es necesaria una clara separación entre la evaluación terapéutica y la económica de los medicamentos innovadores y tener en cuenta el valor social total que aporta el medicamento, es decir, incluyendo ahorros sanitarios y no sanitarios e impacto sobre la productividad y el empleo.
Sería también recomendable el establecimiento de un sistema de acceso temprano de los fármacos que aporten mayor beneficio clínico, con participación de médicos y pacientes y con un precio provisional que se ajuste luego en base a resultados, así como la identificación de las necesidades médicas no cubiertas y mecanismos específicos de precio y financiación para atender las enfermedades raras.
A nivel regional, se propone un seguimiento y mayor coordinación entre las comunidades autónomas para asegurar un acceso equitativo en todo el SNS a los medicamentos incluidos en la prestación, con indicadores de acceso que objetiven la situación y permitan corregir desviaciones.
Finalmente, el documento recuerda que la prescripción por marca refuerza la adherencia al tratamiento (un desafío grande en España, puesto que la mitad de los pacientes crónicos no cumple bien su tratamiento), evita errores en la toma de la medicación, sobre todo en pacientes mayores, y facilita la necesaria labor de farmacovigilancia. Y lo que es clave: la prescripción por marca no es más cara ni para el SNS ni para el paciente, puesto que en España originales y genéricos están al mismo precio. “Estos derechos deben ser protegidos, y la prescripción por principio activo, en consecuencia, carece de fundamento en términos de eficiencia, por lo que su generalización resulta cuestionable”, recalca.
“Estas son sólo algunas de las medidas más destacadas del documento y todas son factibles. Desde la industria farmacéutica innovadora estamos convencidos de que es posible y venimos tendiendo la mano al Ministerio de Sanidad para trabajar conjuntamente en el objetivo común de poner a disposición de los pacientes un sistema sanitario que dé respuesta a sus necesidades, pero también un sistema sanitario de mayor calidad y más eficiente”, concluye Yermo.
✕
Accede a tu cuenta para comentar




