Química
Benceno: un anillo para dominarlos a todos
Es una molécula orgánica sencilla, pero su historia nos lleva desde los padres de la química moderna a los primeros días de la teoría cuántica, y nos obliga a plantearnos qué es y cómo funciona el enlace químico.
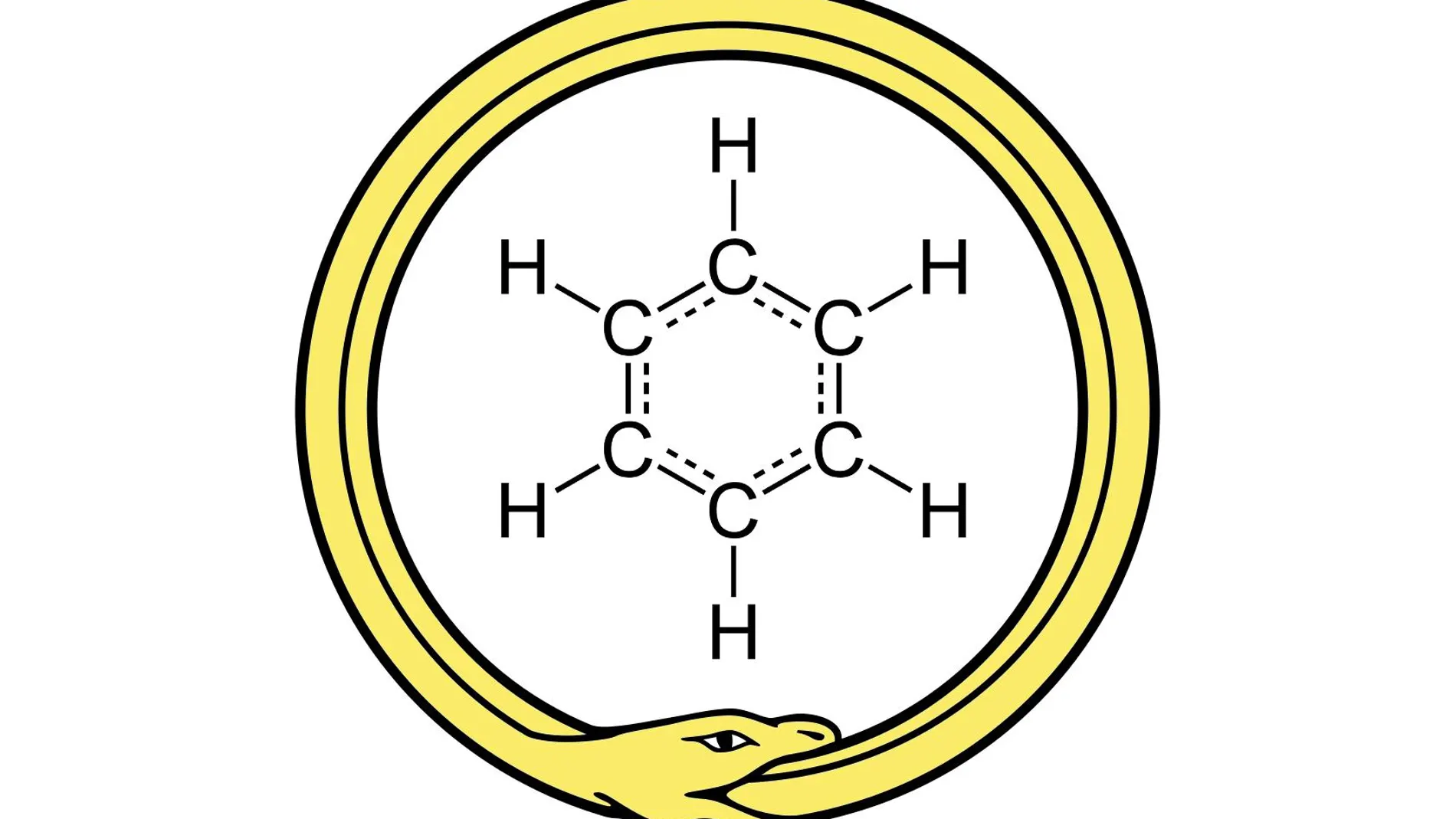
A veces una molécula contiene suficiente ciencia como para llenar 200 años. El benceno, un líquido transparente, poco viscoso y con cierto aroma a gasolina, fue descubierto en 1825 por Michael Faraday, un gigante de este negocio. Nos lo encontramos en el petróleo, en muchas resinas y, en general, en muchas mezclas complejas de sustancias orgánicas que aparecen en la naturaleza. Es químicamente muy estable y no reacciona con facilidad. En el interior de nuestras células, sin embargo, interacciona con varias proteínas y les impide cumplir su función, así que es altamente tóxico y cancerígeno. Quién le iba a decir a Faraday que había descubierto una hidra de la química, tan fascinante como peligrosa.
A required part of this site couldn’t load. This may be due to a browser
extension, network issues, or browser settings. Please check your
connection, disable any ad blockers, or try using a different browser.
El sueño de un genio
Durante décadas la pregunta que todo el mundo se hacía es cuál era el aspecto del benceno. Se sabía que estaba formado por seis átomos de carbono y seis de hidrógeno, pero nadie parecía poder ordenarlos en el espacio de forma que tuvieran sentido. ¿Estaban todos los carbonos en fila india? ¿Formaban una T? ¿Una cruz? Ninguna de esas ideas parecía encajar con los experimentos. Se sabía, por ejemplo, que cuando el benceno reacciona con una sola sustancia da lugar a un único producto. Pero si lo hacemos reaccionar con dos sustancias aparecían… tres productos diferentes. Era un buen rompecabezas, y había que resolverlo sin poder mirar las piezas.
En este punto aparece en escena un experto en esas lides: August Kekulé. En 1857 Kekulé había descubierto que el átomo de carbono tiene valencia 4, o sea, que un átomo de carbono puede unirse a otros cuatro átomos. Un año después propuso que, además, los átomos de carbono pueden unirse entre sí, dando así inicio a la química orgánica.
Kekulé también trató de atacar el problema de la estructura del benceno, y en 1865 anunció que lo había logrado: si uno tomaba los seis átomos de carbono y los hacía formar un anillo, alternando en el anillo enlaces simples y enlaces dobles, a cada carbono sólo le quedaría libre un enlace: uno para cada hidrógeno. Esta estructura, además, explicaba por qué los productos de las reacciones del benceno eran tan peculiares. Cuando el benceno reacciona con una sola sustancia, ésta sustituye a uno de los átomos de hidrógeno; como en el anillo todos los hidrógenos son equivalentes no importa dónde se inserte la nueva sustancia: todos las moléculas finales serán iguales. Sin embargo, cuando uno inserta dos sustancias en lugar de una, la cosa cambia: se pueden insertar en dos carbonos adyacentes (formando un “reloj” que marca la una), o en dos carbonos separados por un tercero (formando un reloj que marca las cuatro), o en dos carbonos en extremos opuestos del anillo (y entonces el reloj marcará las seis). Tres posibilidades, como se observa en los experimentos.
El anuncio de Kekulé fue inmensamente celebrado, pues había puesto fin a uno de los misterios más pertinaces de la naciente química orgánica. Muchos años después, en el año 1890, Kekulé contaría en una conferencia pública que la idea de reunir los átomos de carbono en un anillo le había llegado en un sueño, después de quedarse dormido frente al fuego. Soñó, dijo, con hileras de átomos que bailaban y se contorsionaban delante de sus ojos, como si fueran serpientes. Y entonces una de esas “serpientes” se mordió su propia cola… y Kekulé despertó inmediatamente, sabiendo que había encontrado la respuesta. Nadie sabe cuánto hay de verdadero y cuánto de fábula en esta maravillosa anécdota, pero ciertamente somos afortunados de que Kekulé nunca se desdijera de ella.
Resonancias y nubes de electrones
La intuición de que los seis átomos de carbono e hidrógeno podían encajar en un anillo con enlaces dobles y simples alternados había sido brillante, pero para tumbar a un peso pesado como el benceno iba a hacer falta un poco más de trabajo. Poco después del anuncio de Kekulé en 1865 el químico Albert Ladenburg señaló un defecto en su estructura: si era verdad que en el anillo había enlaces dobles y enlaces simples entonces el benceno, al reaccionar con dos sustancias, no debería generar tres productos, sino muchos más. Por ejemplo, cuando las dos sustancias se enlazaban a átomos de carbono aledaños (o sea, cuando forman “el reloj que marca la una”) ¿no debería ser diferente cuando esos carbonos están separados por un enlace simple o por uno doble?
Kekulé reconoció que, efectivamente, así era. Su estructura sólo tenía sentido si los seis carbonos eran equivalentes, y por tanto sus seis enlaces debían ser idénticos también. Pero para cuadrar las valencias era necesario que hubiera un enlace doble y después uno simple, uno doble y otro simple… ¿cómo se podían conciliar estos dos hechos? Kekulé propuso que lo que ocurría es que la molécula de benceno no era estática: los enlaces que hace un momento eran dobles se transformaban en simples, y viceversa, a una gran velocidad. La molécula oscilaba entre estos dos estados, y nosotros veíamos una especie de “promedio” de los dos, en el que todos los enlaces eran equivalentes. A este fenómeno se le llamaría después resonancia, como si la molécula estuviera vibrando como una campana.
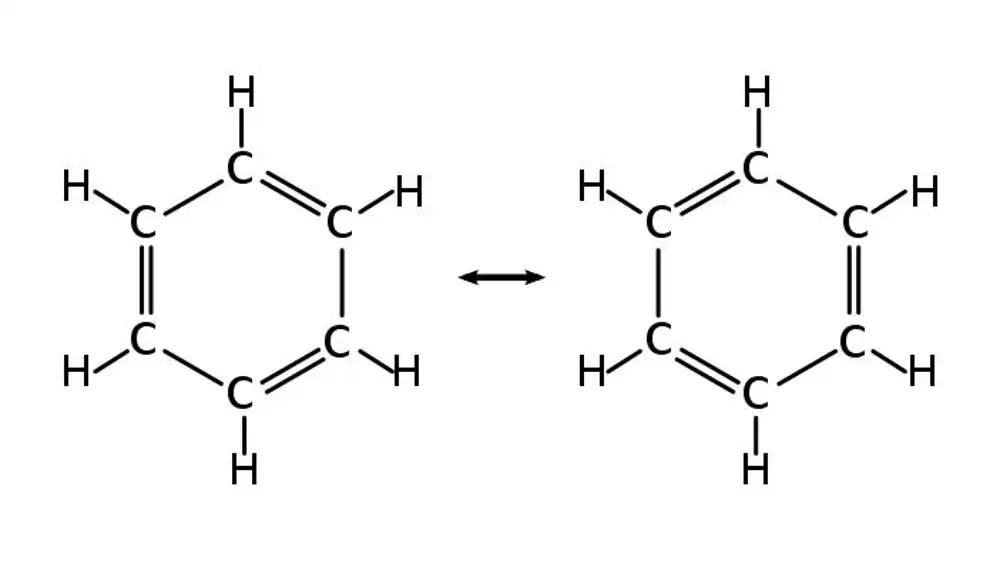
La noción de resonancia es útil, porque nos permite contemplar la molécula de benceno como Kekulé quería: formada por átomos que tienen entidad individual, cada uno con sus propiedades, y cuyos enlaces dependen sólo de cada átomo y sus vecinos. Sin embargo, con la llegada de la física cuántica en el siglo XX apareció otra forma de describir estas propiedades peculiares que tiene el benceno, y con ella un nuevo punto de vista sobre las propiedades químicas.
En el año 1916 otro químico gigantesco, Gilbert Lewis, propuso que los enlaces entre átomos eran debidos a que los átomos comparten electrones: un electrón, en lugar de quedarse en torno a su propio átomo, gira en torno a éste y al átomo de al lado, y de esta forma ambos átomos quedan unidos. La idea era fabulosa, porque permitía entender la noción de valencia con la que Kekulé y otros habían trabajado durante décadas en términos de la estructura microscópica de los átomos.
Pero el siglo XX es el siglo de la teoría cuántica, y en física cuántica los electrones no son pelotitas que giran en torno a los núcleos de los átomos. Se parecen más bien a una “nube” que rodea al átomo en todas direcciones, y que puede ser esférica, o alargada, o tener forma de mariposa, según las propiedades del electrón. Si los electrones son los responsables del enlace químico el hecho de que el electrón “tenga forma” debería afectar a los enlaces. Y efectivamente, el benceno es un estupendo ejemplo de esto.
Analizando cómo son esas nubes de electrones en los átomos del benceno nos damos cuenta de una estructura notable: cada átomo de carbono tiene cuatro electrones disponibles (las cuatro valencias de Kekulé), y las nubes de tres de ellos están orientadas de forma que el carbono enlace con otro carbono a su izquierda, con un tercer carbono a su derecha y con un hidrógeno. Esos electrones, pues, forman el “armazón” de la molécula de benceno. Dan lugar al anillo y retienen a los átomos de hidrógeno para que no se escapen. Pero a cada carbono le sobra un electrón. ¿Qué es lo que hace ese electrón solitario?
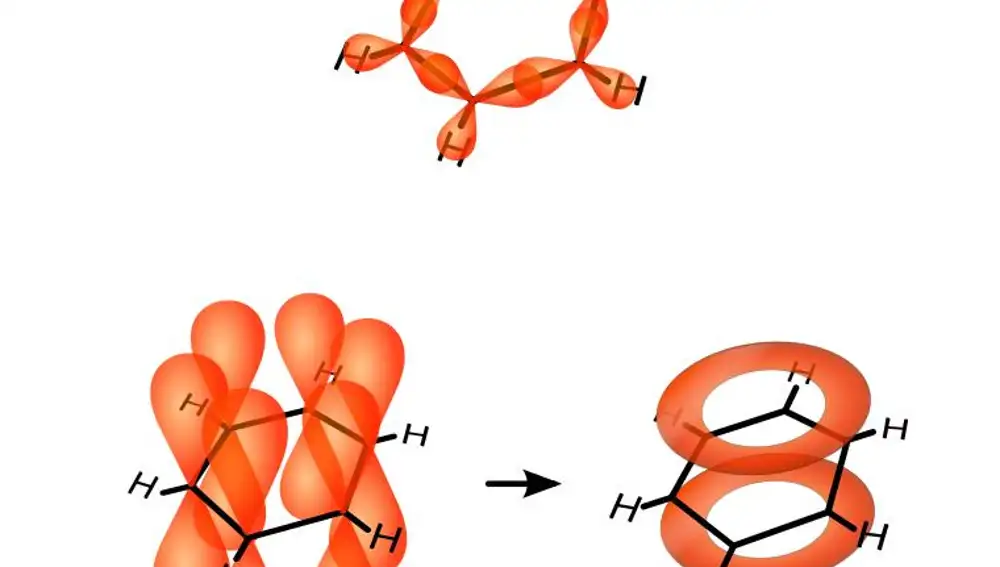
Esos electrones son el corazón de la molécula de benceno, y la fuente de muchas de sus propiedades. Sus nubes están orientadas “en la dirección incorrecta”, perpendiculares al anillo, así que uno pensaría que no se pueden usar para hacer química. Y nada más lejos de la realidad: las seis nubes, una para cada átomo, están situadas por encima y por debajo del anillo, y cuando se forma la molécula las seis se unen para formar dos anillos adicionales, uno por encima y otro por debajo del anillo principal. En ese punto esos electrones dejan de pertenecer a un átomo en concreto: le pertenecen al anillo, a toda la molécula de benceno.
Desde el punto de vista de Kekulé, esos electrones “comunitarios” son los dobles enlaces: un refuerzo extra que cada átomo de carbono aporta al anillo. Para Kekulé esos enlaces debían estar asociados a dos átomos de carbono y sólo a dos, pero ahora sabemos que los electrones están distribuidos por los seis átomos de carbono. Por eso Kekulé necesitaba la noción de resonancia: para “emborronar” esos electrones y diluirlos por toda la molécula. Y ojo, Kekulé no pensó nunca en electrones ni sabía nada de física cuántica. Simplemente se dio cuenta de estas cosas y las expresó en otro lenguaje.
El anillo más fuerte
Esos anillos de electrones que cubren toda la molécula tienen consecuencias muy importantes para la química del benceno. Otras moléculas con forma de anillo, como el ciclohexano, tienen sólo el armazón, sólo los enlaces localizados. Comparado con ellas, el benceno es mucho más estable: reacciona mucho menos y es más difícil de romper. Esto se debe a que el armazón por sí solo se puede doblar, retorcer y, con la suficiente energía, partir. El anillo de benceno, en cambio, tiene una protección especial: la de esa nube de electrones que orbita sobre el anillo y ha sido, en cierta manera, creada por él.
La historia del benceno es la historia de cómo llegamos a entender qué es el enlace químico y por qué a veces tiene propiedades inesperadas. Esa historia continúa a día de hoy: aunque entendemos muy bien la mayoría de sus propiedades se sigue discutiendo cuáles de ellas podemos atribuir a átomos individuales y cuáles hemos de otorgar a la molécula como conjunto. En definitiva, seguimos teniendo preguntas sobre cuál es la mejor manera de entender estas fantasías de la química.
QUE NO TE LA CUELEN
- Las dos descripciones de la molécula de benceno, con dobles enlaces y resonancias, o con un orbital molecular que cubre todo el anillo, son equivalentes. La primera hace énfasis en las propiedades de átomos individuales y la segunda en la molécula como conjunto.
REFERENCIAS
- August Kekulé y O. Theodore Benfey. August Kekulé and the birth of the structural theory of organic chemistry in 1858. Journal of Chemical Education, vol. 35, no. 1, pp. 21-23 (1958)
- David L. Cooper et al. The electronic structure of the benzene molecule. Nature, vol. 323, pp. 699–701 (1986)
- Peter A. Schultz y Richard P. Messmer. Are there π bonds in benzene? Physical Review Letters, vol. 58, pp. 2416-2419 (1987)
- Richard P. Messmer et al. Theoretical evidence for “bent bonds” in the CO2 molecule. Chemical Physics Letters, vol. 126, is. 2, pp. 176-180 (1986)
- Yu Liu et al. The electronic structure of benzene from a tiling of the correlated 126-dimensional wavefunction. Nature Communications, vol. 11, article no: 1210 (2020)
✕
Accede a tu cuenta para comentar