Sanidad
Esperas de entre dos y cuatro años para acceder a fármacos en España
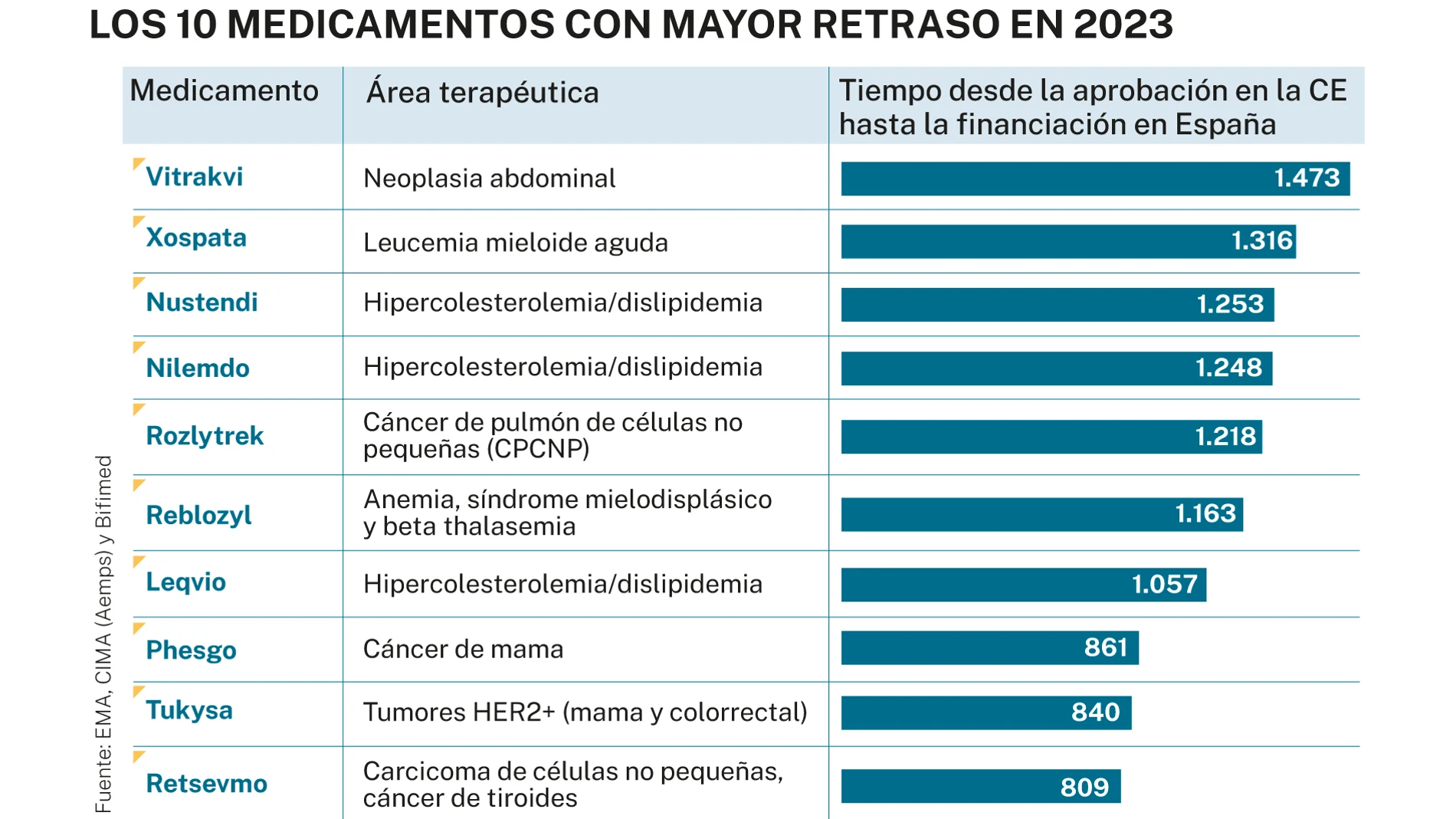
De los 43 medicamentos cuya financiación fue aprobada por Sanidad y las CC AA en 2023, 10 suman el tiempo récord de espera. Entre ellos, uno revolucionario para el colesterol y tres huérfanos para pacientes sin alternativa terapéutica
Los 661 días de media que tardó Sanidad en financiar los medicamentos innovadores en 2023 son solo eso, una media. Los 43 fármacos cuya financiación fue aprobada por la Comisión Interministerial de Precios de Medicamentos (CIMP) el año pasado se incluyeron en el Sistema Nacional de Salud (SNS) 599 días (1 año y medio) después de que la compañía farmaceútica que los desarrolló manifestara su interés en comercializar en España y solicitara su financiación, y 696 días (1 año y nueve meses) después desde su autorización por parte de la Comisión Europea, según datos públicos de la Agencia Europea de Medicamentos (EMA), Bifimed (buscador de información sobre la situación de financiación de los medicamentos en España) y el Centro de Información de Medicamentos (CIMA) de la Aemps.
Pero hubo 10 medicamentos que alcanzaron cifras récord de espera, entre los 2 y los 4 años, según ha investigado este periódico. Recordemos que tanto la legislación europea como la española establecen que el máximo tiempo debe ser 180 días. Estos fármacos llegaron a multiplicar esa cifra por 10. La mitad de ellos son oncológicos y, 3, huérfanos. Además, como veremos, representan fielmente lo que indica el informe WAIT de 2023: que más de la mitad de los medicamentos (52%) que obtienen financiación en España lo hacen con restricciones en cuanto a las indicaciones para las que pueden ser prescritos.
El primero en la lista es larotrectinib (Vitrakvi), cuya inclusión en el SNS se ha producido este mes, con un retraso de 1.473 días (más de 4 años). Eso sí, con restricciones. Este medicamento ha demostrado cuadruplicar la esperanza de vida- de 10 a 40 meses (casi 4 años)- en pacientes adultos y pediátricos con tumores sólidos con una enfermedad localmente avanzada, metastática o cuya resección quirúrgica probablemente genere una elevada morbilidad, y con ausencia de opciones terapéuticas satisfactorias. El Ministerio de Sanidad llevaba tres años rechazando su financiación, alegando, por un lado, que los datos de eficacia y seguridad eran "preliminares" y que su aprobación por parte de la EMA era provisional y, por otro, criterios de racionalización del gasto público e impacto presupuestario del SNS.
Le sigue muy de cerca gilteritinib (Xospata), una molécula que detiene el crecimiento de las células cancerosas para tratar la leucemia mielógena aguda (LMA). Nada menos que 1.316 días (3 años y 6 meses) han pasado desde que el laboratorio farmacéutico que lo comercializa solicitó su financiación hasta la reciente aprobación, hace unos días. El fármaco está indicado en monoterapia para el tratamiento de pacientes adultos con LMA recidivante o refractaria con mutación FLT3, pero excluye a los pacientes con riesgo citogenético desfavorable y en el tratamiento de mantenimiento tras alo-trasplante de células madre hematopoyéticas.
El siguiente es Nustendi (ezetimiba), un medicamento para los pacientes que no alcanzan los objetivos de colesterol c-LDL marcados por las guías clínicas con los tratamientos habituales (entorno a un 65% en España) y que, por ello, tiene un riesgo exponencialmente mayor de sufrir un infarto o un ictus. Esta innovación ha tardado en financiarse en España 3 años y 4 meses (1.253 días). Algo similar ha sucedido con otro principio activo, el ácido bempedoico (Nilemdo), considerado el primero de una nueva generación de fármacos que reducen el colesterol en personas de alto riesgo cardiovascular, cubriendo una necesidad para la cual no existían alternativas orales. Este ha tardado 3 años y 3 meses (1.248 días) en incluirse en el SNS, y también con restricciones.
Sin alternativa terapéutica
El quinto en la lista es entretinib (Rozlytrek) una innovadora terapia dirigida indicada tanto en tumor agnóstico como en cáncer de pulmón, que se ha retrasado unos 3 años (1.218 días) para los pacientes españoles. Las terapias con indicación tumor agnóstico, independientes de la localización y/o de la histología del cáncer, son un tipo de tratamiento oncológico dirigido a tratar el tumor según sus características genéticas y moleculares, sin tener en cuenta el órgano afectado. Estas opciones representan un cambio significativo en el tratamiento del cáncer.
Le sigue luspatercept (Reblocyl), con 1.163 días de retraso. Este fármaco es un agente de maduración eritroide (EMA), el primero de este tipo, indicado para el tratamiento de pacientes adultos con anemia dependiente de transfusiones debida a síndromes mielodisplásicos de riesgo muy bajo, bajo e intermedio. Ha demostrado que mejora la capacidad medular para producir glóbulos rojos y, de esta forma, aumenta el nivel de hemoglobina en sangre.
La "vacuna" del colesterol
El séptimo en la lista, con 1.057 días de retraso en España, es un fármaco revolucionario que permite reducir a la mitad los niveles de colesterol "malo" con sólo dos inyecciones al año.Inclisirán (Leqvio) fue denominado extraoficialmente como "la vacuna del colesterol" y ha supuesto un antes y un después para las personas con enfermedad cardiovascular ateroesclerótica, en quienes consigue una reducción potente y sostenida del c-LDL de hasta un 54%.
Innovación oncológica
Las tres últimas posiciones las ocupan tres medicamentos oncológicos para tumores muy prevalentes y con biomarcadores bien identificados. El primero, con un retraso de 2 años y dos meses aproximadamente (861 días) es Phesgo (nombre genérico para tres medicamentos unidos: pertuzumab, trastuzumab e hialuronidasa) frente al cáncer de mama precoz y metastásico HER 2 positivo, en combinación con quimioterapia. Le sigue tucatinib (Tukysa), un inhibidor de la tirosina cinasa indicado, en combinación con otros dos fármacos en el tratamiento de pacientes adultos con cáncer de mama HER 2 positivo, localmente avanzado o metastásico, que han recibido al menos 2 líneas previas de tratamiento anti HER 2. Su financiación se aprobó en abril de 2023, tras una larga espera de 840 días. Por último, selpercatinib (Retsevmo), primer y único inhibidor selectivo del gen RET en cáncer de pulmón no microcítico y cáncer de tiroides, cuya financiación se aprobó a finales de junio de 2023, con más de 26 meses de retraso (809 días).
Madrid pide cambios urgentes en la CIMP
La Comunidad de Madrid volvió a reclamar esta semana al Ministerio de Sanidad "cambios urgentes" en el funcionamiento de la CIPM, adscrita a la Secretaría General de Sanidad y Consumo, ante los retrasos de 661 días en la financiación de medicamentos. Cambios en este órgano, dijo la consejera de Sanidad de la Comunidad de Madrid, Fátima Matute, "que no necesitan ni pueden esperar a una ley". "Todas las administraciones nos vamos a alinear para poder conseguir esos fármacos en menor tiempo, precisamente para lograr esa equidad, esa sostenibilidad y ese acceso igualitario a nuestro Sistema Nacional de Salud", añadió.
El programa de medicamentos prioritarios (Prime, por sus siglas en inglés) recoge 26 medicamentos, "de los que en España tenemos 15", indicó Matute, y señaló que hay que llegar a estos 26 "para esa medicina de precisión y personalizada".
✕
Accede a tu cuenta para comentar





