
Investigación
Descubren la diana para neutralizar una proteína tóxica asociada al párkinson
Investigadores de la Universidad Autónoma de Barcelona hallan dónde, cómo y cuándo se desencadena un mecanismo molecular fundamental para el desarrollo de la enfermedad. Este hallazgo abre la puerta a crear nuevas estrategias terapéuticas para inactivarlo
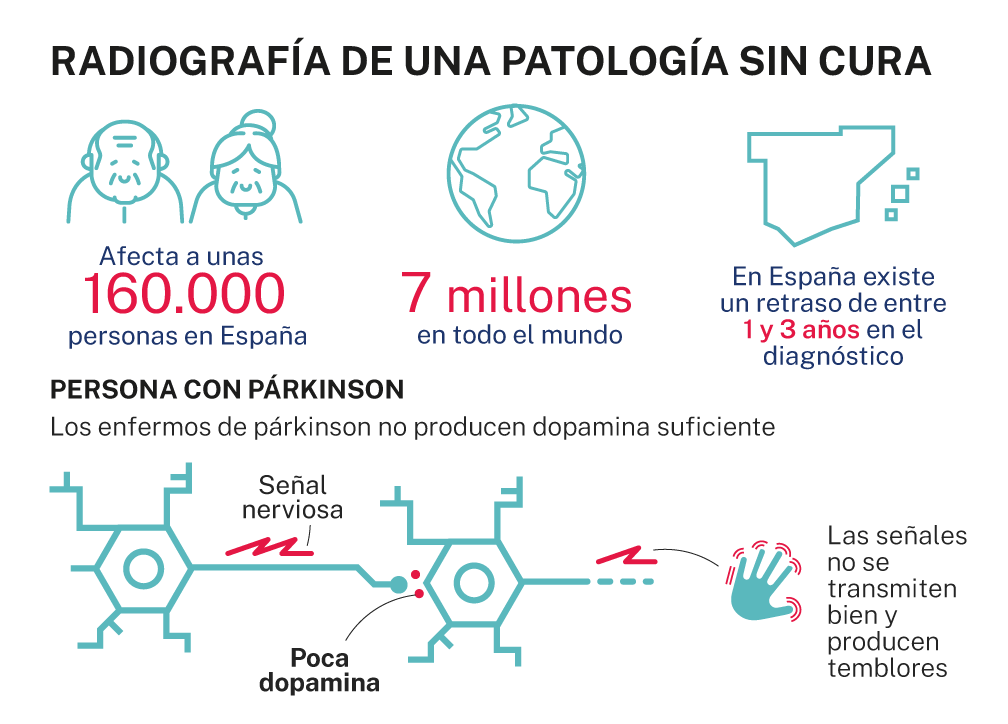
La muerte de las neuronas especializadas en la síntesis de dopamina, uno de los principales neurotransmisores cerebrales, deteriora las capacidades motoras y cognitivas de las personas afectadas por la enfermedad de Parkinson. En la pérdida de estas neuronas está implicada la agregación de la alfa-sinucleína.
Pues bien, investigadores de la Universidad Autónoma de Barcelona (UAB) han identificado una región en la que se pueden neutralizar las formas tóxicas de la proteína asociada al párkinson.
En concreto, se trata de una región en los agregados iniciales de la proteína alfa-sinucleína que es atacable, lo que evitaría su conversión en las fibras amiloides tóxicas que se acumulan en el cerebro de las personas afectadas por la enfermedad.
El descubrimiento, que ha sido publicado en el "Journal of the American Chemical Society", abre la puerta a desarrollar nuevas estrategias terapéuticas para inactivar esta enfermedad que sufren al menos 150.000 personas en España.
Algo crucial frente a esta patología neurodegenerativa, la segunda más frecuente después del alzhéimer y la previsión es que el número de afectados se triplique para 2050 por el aumento de la esperanza de vida y una mayor exposición a tóxicos, entre otros factores.
La investigación la han llevado a cabo los investigadores del Instituto de Biotecnología y de Biomedicina (IBB-UAB) y del Departamento de Bioquímica y Biología Molecular Salvador Ventura, Jaime Santos, Jordi Pujols e Irantzu Pallarès.
Los científicos habían observado en un estudio previo que una pequeña molécula, el péptido bacteriano PSMα3, inhibía la agregación de la alfa-sinucleína al unirse a los oligómeros, bloqueando la conversión en fibrillas y anulando su neurotoxicidad.
En este trabajo han identificado dónde, cómo y en qué momento se produce esta unión en los oligómeros, y han descubierto una región fundamental para el proceso de conversión estructural asociado a la patogénesis del párkinson.
“Hemos identificado la secuencia de la estructura indispensable para que los oligómeros hagan la transición a fibrillas, abriendo así un nuevo campo de exploración en el diseño de moléculas dirigidas a atacar los oligómeros. Usando esta región podremos desarrollar nuevas moléculas que imiten las propiedades del PSMα3 con una afinidad y eficacia muy superiores”, explica en un comunicado Salvador Ventura, director del grupo de investigación de Plegamiento de Proteínas y Enfermedades Conformacionales en el IBB-UAB y coordinador del estudio.
Combinando análisis estructurales, biofísicos y bioquímicos, los investigadores han observado que el PSMα3 actúa uniéndose a un extremo de la alfa-sinucleína (N-terminal) que regula el proceso de conversión de los oligómeros en fibras.
Al unirse, el péptido cubre dos pequeñas regiones adyacentes de la proteína, P1 y P2, que han descubierto que son críticas para esta transición patogénica. “Esta región es una diana terapéutica ideal, porque solo es reconocida por los péptidos cuando forman parte de los oligómeros; esto nos permite atacar los agregados sin impactar en la forma monomérica funcional de alfa-sinucleína, que es necesaria para el correcto funcionamiento cerebral”, destaca Salvador Ventura.
El estudio también es relevante para profundizar en el conocimiento de los mecanismos moleculares implicados en el párkinson familiar.
Esta variante del párkinson, que suele afectar a las personas en edades más jóvenes, está frecuentemente asociada a mutaciones localizadas en la región P2 de alfa-sinucleína, como la mutación G51D, que genera una de las variantes más agresivas de la enfermedad.
Los investigadores demuestran que la mutación G51D en la región crítica identificada provoca fluctuaciones conformacionales que retrasan la transición de los oligómeros en fibrillas.
Este retraso provocaría la acumulación de oligómeros tóxicos de larga vida que no son procesados eficientemente por las chaperonas moleculares que intentan mantenerlos desagregados.
En lugar de esto, capturarían elementos esenciales de esta maquinaria de control proteico que son necesarios para el correcto funcionamiento de las neuronas.
La evasión o el deterioro del funcionamiento correcto de la maquinaria de control proteico podría explicar por qué esta y otras mutaciones hereditarias desencadenan la aparición del párkinson a edades muy jóvenes.
“Nuestro descubrimiento podría dar lugar a desarrollar péptidos específicos para atacar estas formas mutadas de alfa-sinucleína y, por lo tanto, a una aproximación de terapia personalizada para las personas afectadas por el párkinson familiar. Ya estamos trabajando en el desarrollo de estas moléculas”, afirma Salvador Ventura.
En el estudio han participado también investigadores de las universidades del País Vasco, de Burdeos, de Leeds y de Aarhus, y del Centro Nacional de Biotecnología (CNB-CSIC).
✕
Accede a tu cuenta para comentar

Experiencias en el extranjero



